Giuseppe Di Bella 20 Dicembre 2009
Abbreviazioni:All Trans Retinoic Acid (ATRA)
Brain Derived Neurotrophic Factor (BDNF)
Cholecystokinin (CCK)
Di Bella Method (MDB)
Epidermal Growth Factor (EGF)
Epidermal Growth Factor Receptor (EGFR)
Fibroblastic Growth Factor (FGF)
Growth Hormone (GH)
Growth Hormone Receptor (GHR)
Hepatocyte Growth Factor (HGF)
Insulin-like Growth Factor 1-2 (IGF 1-2)
Insulin-like Growth Factor Receptor (IGFR)
International Neuroblastoma Staging System (INSS)
Magnetic Resonance Imaging (MRI)
Melatonin (MLT)
Neuroblastoma (NBL)
Nerve Growth Factor (NGF)
Neurotrophin (NT)
Non-Hodgkin’s Lymphoma (NHL)
Platelet-Derived Growth Factor (PDGF)
Positron Emission Tomography (PET)
RC (Complete objective response)
Somatostatin (SST)
Somatostatin Receptor (SSTR)
Tyrosin-chinasi (TRK)
Transforming Growth Factor (TGF)
Vascular Endothelial Growth Factor (VEGF)
Vasoactive Intestinal Peptide (VIP)
L’impiego sinergico di Somatostatina, Melatonina, Retinoidi, Vitamine E, C, D3, con Calcio, Condroitinsolfato, microdosi di Ciclofosfamide, (MDB) in un bimbo di sette mesi affetto da un voluminoso neuroblastoma retroperitoneale di cm 4x8 ha prodotto, in sei mesi una risposta obiettiva del 50%, pressochè totale ad un anno, completa a 14 mesi, con guarigione e assenza di malattia da oltre dieci anni. Vengono discussi il razionale e i meccanismi d’azione molecolari della terapia, che esercita un effetto differenziante, apoptotico, antiproliferativo, preservando ed esaltando, sia il trofismo e la funzionalità di organi e tessuti, che l’omeostasi neuroimmunoendocrina e antiblastica. Questo risultato è conforme ai positivi risultati già pubblicati sull’uso del Metodo Di Bella nelle malattie linfoproliferative, nei carcinomi polmonari al 3° e 4° stadio, nel carcinoma della mammella, e nei carcinomi degli epiteli aerodigestivi superiori. Il MDB, senza necessità di ricovero, in assenza di tossicità, ha rapidamente ridotto, e poi eliminato, la voluminosa massa tumorale consentendo una normale qualità di vita e uno sviluppo psicofisico perfettamente regolare. Riteniamo utile segnalare il caso per invitare ad un maggiore interesse sulle possibilità aperte in oncologia dalla terapia immunoneuroendocrina e biologico-recettoriale del Metodo Di Bella.
Introduzione
Si presenta un caso di remissione completa (RC) con terapia biologica (MDB) di un voluminoso neuroblastoma retroperitoneale (NBL), inoperabile, in un bimbo di sette mesi. Il caso è stato monitorato dal 1998 ad oggi. Sono riportati i componenti della terapia biologica (MDB) effettuata, gli esami ematochimici e strumentali, prima e dopo il trattamento.
Si descrivono, in estrema sintesi, il razionale del MDB, le basi scientifiche, i meccanismi d’azione molecolari e la risposta clinica, con guarigione da oltre 10 anni.
Cenni sintetici sul neuroblastoma
Il NBL origina dalle cellule della cresta neurale, colpisce le cellule nervose dei gangli simpatici ed è considerato di origine ereditaria.
E’ il tumore solido extracranico più comune dell’età pediatrica rappresentando il 6-10% di tutti i tumori dei bambini con incidenza di 7-13 nuovi casi annui/1.000.000 (bambini < 15 anni) .
Ha una presentazione clinica ed un comportamento biologico estremamente variabili. Il sistema di valutazione del rischio formulato dal Children's Oncology Group, oltre a dati istologici e istochimici, considera l’età dei pazienti, il volume della massa neoplastica e lo stadio secondo i criteri INSS (International Neuroblastoma Staging System):
|
Stadio 1 |
T unilaterale o della linea mediana confinato alla sede di
origine, asportato in modo completo con linfonodi negativi o metastatici, ma
asportati in blocco con la stessa. |
|
Stadio 2A |
T unilaterale o della linea mediana asportato in gran parte
ma non radicalmente e con linfonodi negativi |
|
Stadio 2B |
T unilaterale o della linea mediana asportato radicalmente,
ma con linfonodi positivi |
|
Stadio 3 |
T che supera la linea mediana infiltrando i tessuti
circostanti ± LN regionali
T che non supera la linea mediana ma con LN contro laterali
positivi
T ad origine dalla linea mediana ma non asportabile in modo
ampio per l’infiltrazione dei tessuti circostanti |
|
Stadio 4 |
T con disseminazione di LN a distanza, scheletro, midollo,
fegato, cute e/o altro |
|
Stadio 4S |
T localizzato come per Stadio 1 e 2, con disseminazione
limitata a cute, fegato e/o midollo emopoietico (con infiltrazione minima
<10%) valido solo 1 anno |
Il NBL produce spesso catecolamine (per questo è detto secernente), determinandone alti livelli nelle urine e nel sangue, utili per la diagnosi e il monitoraggio. In diversi casi si verificano ipertensione e tachicardia, anche se non sempre in coincidenza con l’incremento delle catecolamine e degli altri cataboliti del sistema simpatico. Il NBL può colpire la ghiandola surrenale (presentandosi come una tumefazione addominale) o i gangli simpatici paraspinali, potendo comparire in qualsiasi tratto della colonna vertebrale (addominale e toracica).
Segni frequenti di malattia sono: febbre, anemia, disappetenza, ecchimosi intorno alle orbite. Le metastasi, frequenti e precoci, colpiscono le ossa, la regione dell’orbita, i linfonodi, il fegato e il midollo osseo. La diagnosi precoce è fondamentale poiché se si interviene chirurgicamente nei primi stadi di malattia la sopravvivenza è più elevata; a tal fine devono essere ricercati i metaboliti urinari delle catecolamine (acido vanilmandelico, acido omovanillico) e marcatori neuroendocrini (NSE). Anche Ferritina e LDH sono parametri da valutare per il monitoraggio del NBL.
L’estensione della malattia va valutata con indagini strumentali, TAC, MRI, PET, urografia. Nella maggior parte dei casi, al momento della diagnosi, il NBL può presentarsi già metastatizzato. Nel NBL analisi citogenetiche documentano una serie di punti di rottura del cromosoma 1 p da 1 P22 a 1 P 36. Delezioni e perdite alleliche di 1 P sono presenti non solo nel NBL, ma in un’ampia gamma di neoplasie solide ed ematologiche. La regione distale del braccio corto del cromosoma 1 contiene uno o più geni implicati nello sviluppo delle neoplasie.
Caso clinico:
Neuroblastoma (classification: T4N2Mx)
stadio 3 INSS
Profilo anagrafico del paziente: anno di nascita: 1998 Sesso: maschio
Anamnesi - Il bambino, nato da parto eutocico nel maggio 1998, nel mese di novembre dello stesso anno cominciò ad accusare continui disturbi all’apparato digerente, per il progressivo aggravamento dei quali, fu ricoverato all’ospedale di Avola, in Sicilia, dove mediante ecografia e TAC, effettuate in data 17 dicembre 1998, fu evidenziata una voluminosa neoformazione solida occupante spazio in sede retroperitoneale medio-laterale SN (cm 4x8) classificata come NBL. Secondo i criteri di classificazione dei NBL (International Neuroblastoma Staging System) il caso in questione rientra chiaramente in uno Stadio 3 (tumori inoperabili infiltranti la linea mediana con o senza interessamento dei linfonodi regionali).
Inizial Routine Tests
TC Addome - 17 dicembre 1998
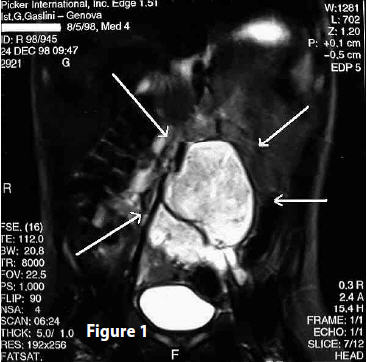
Referto - “ L’esame TC dell’addome superiore ed inferiore, eseguito in condizioni basali, evidenzia presenza di grossa formazione solida occupante spazio in sede retroperitoneale medio-laterale sinistra con massima ampiezza trasversale di circa 4 cm. e massima ampiezza longitudinale di circa 8 cm. Detta formazione ha struttura disomogenea, presenta numerose calcificazioni nel suo contesto; sposta anteriormente le anse intestinali e lateralmente a destra l’aorta e prende intimi rapporti con il margine anteriore della colonna vertebrale… L’aspetto TC di detta formazione è compatibile per Neuroblastoma…”. (Fig 1)
Trasferito, dopo la TAC all’Ospedale Pediatrico “Gaslini” di Genova (Istituto di Ricerca e Cura a Carattere Scientifico) il 24 dicembre 1998 veniva sottoposto a MRI dell’addome superiore e inferiore, e ad urografia in anestesia generale.
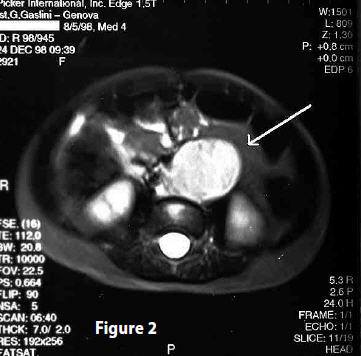
MRI (24 dicembre 1998) Referto: “Non si evidenziano lesioni secondarie epatiche. Non linfoadenomegalie periaorto-cavali prox. Nella norma i reni e la milza. Si conferma la presenza di grossolano processo espansivo, che si estrinseca da subito caudalmente il peduncolo vascolare renale fino ad oltre il carrefour aorto bisiliaco. La massa è mediana con prevalente estrinsecazione verso sinistra (superamento della linea mediana), con dislocazione dello psoas omolaterale. La struttura è solida senza evidenza di fenomeni necrotico-colliquativi. Il segnale è francamente iperintenso in T2 con aspetto puntiforme diffuso ipointenso per presenza di calcificazioni. L’aorta e la cava distali, la biforcazione e le arterie e vene iliache (più a sinistra) sono inglobate marginalmente e dislocate verso destra. Non liquido in peritoneo.” (Fig 2)
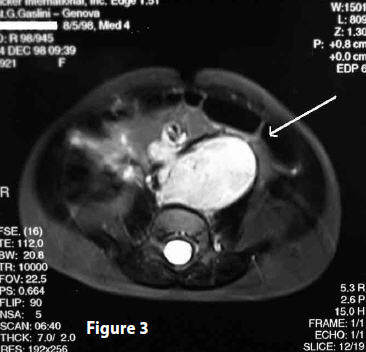
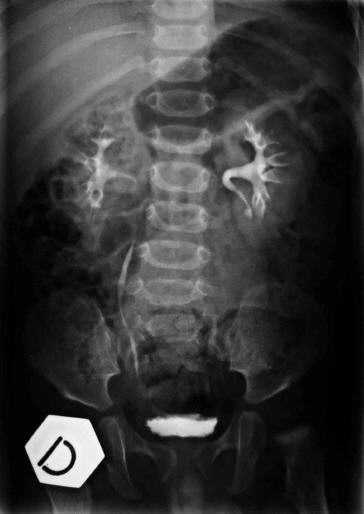
Urografia (28 dicembre 1998) Referto: “Pronta eliminazione e regolare concentrazione del mezzo di contrasto iodato da parte di entrambi gli emuntori renali. A dx regolare morfologia calico pielica e ureterale. A sn nella norma la morfologia calico pielica, l’uretere presenta un normale calibro, ma un alterato decorso, nella proiezione AP ( antero-posteriore), il tratto prossimale appare spostato verso l’esterno, mentre in LL (Latero-laterale) appare anteriorizzato il suo tratto intermedio, verosimilmente dislocato dalla massa retro peritoneale”, (Fig 3)
All’Istituto “Gaslini” fu confermata la diagnosi di Neuroblastoma formulata all’Ospedale di Avola. Fu prospettato ai genitori il rischio inaccettabile di un intervento chirurgico, oltre che per l’età, anche per il volume e la forte vascolarizzazione della massa neoplastica, e soprattutto per la difficoltà di individuare piani di clivaggio con l’aorta e la vena cava distali, la biforcazione e le arterie e vene iliache, vasi tutti inglobati dalla massa neoplastica e dislocati a sn.
Il volume particolarmente rilevante del tumore addomino-pelvico (8 cm x 4 in un bimbo di 7 mesi ) con dislocazione dell’uretere e la compressione sulle anse intestinali, stava causando disturbi gastroenterici, coliche, vomito alimentare. Fu proposto un trattamento chemioterapico. Una soluzione si rendeva comunque urgente per il persistere della sintomatologia gastroenterica, l’aggravamento delle condizioni del bimbo, e la rapida progressione della neoplasia. I genitori rifiutarono la chemioterapia e pertanto, nel gennaio 1999, il bimbo veniva dimesso dall’Istituto “Gaslini” con una relazione per la Clinica Pediatrica di Catania, in cui si specificava che: “il sospetto di Neuroblastoma è stato consolidato dalle indagini relative alla escrezione urinaria di amine-simpatiche:
Pathological haemato-chemical values
- Acido
Vanilmandelico: 35,6 gamma /mg –
creatina
- Acido Omovanillico : 79,7 gamma/mg
-creatina
- NSE: 30 – LDH: 603
- Emocromo : Hb 12,9 - Glob.Bianchi : 15900 (con normale formula
leucocitaria)
- Piastrine : 474000
- MRI addominale: grossolano processo
espansivo al di sotto del peduncolo vascolare
renale, prevalente a sinistra
- Urografia endovenosa: alterato decorso dell’uretere sinistro
Results
Therapy and clinical course
I genitori decisero di rinunciare alla chemioterapia e di applicare il Metodo Di Bella.
Di seguito viene riportata la terapia prescritta dal professor Luigi Di Bella e iniziata immediatamente dopo la dimissione:
1) Soluzione di:
- Acido Tutto-Trans Retinoico gr 0,5
- Axeroftolo palmitato gr 0,5
- Betacarotene gr 2
- Alfatocoferile acetato gr 1.000
un cucchiaino con 2 ml di Soluzione ogni 3 ore
insieme a:
2) Diidrotachisterolo (una goccia nel cucchiaino per ogni somministrazione)
3) Bromocriptina compresse da 2,5 mg (1/4 di compressa 2 volte al dì, mattino e sera)
4) Melatonina 12%, Adenosina 51%, Glicina 37% (una fiala liofilizzata da 5 mg diluita in acqua)
5) Condroitinsolfato (una fiala orale da 500 mg a cena)
6) Ciclofosfamide compresse 50 mg (1/4 di compressa, al pasto principale)
7) Somatostatina 14 aminoacidi (fiala 0,25 mg lentamente sottocute la sera).
La terapia fu tollerata e fu programmato, ogni 2 settimane, un controllo degli esami ematochimici.
Si registrò un miglioramento delle condizioni generali del bambino con una progressiva riduzione delle coliche, della diarrea, vomito, dell’anoressia e con recupero del peso. Già alla fine del 1999 la crescita ponderale e staturale, così come lo sviluppo psicofisico del bimbo, erano rientrate nei limiti fisiologici. Alla graduale remissione dei sintomi si associò la progressiva normalizzazione dei dati ematochimici, con riduzione della leucocitosi, della VES, di LDH, Ferritina, delle Catecolamine, NSE, Ac Vanil mandelico, Ac Omovanillico. Per i primi mesi l’emocromo è stato effettuato ogni 2 settimane. Il monitoraggio emato-chimico completo è stato effettuato ogni 2-3 mesi in quanto, oltre a rivestire un valore diagnostico elevato, è utile nella sorveglianza dello stato di remissione, per cogliere precocemente recidive, prima di ogni eventuale evidenza clinica. Al miglioramento del quadro emato-chimico fece riscontro la sensibile e continua riduzione volumetrica della massa neoplastica rilevata dalle indagini strumentali. Dopo 40 giorni dall’inizio del MDB, un’ecografia addominale del 12 febbraio 1999 evidenziava una riduzione della neoplasia refertando: “… In corrispondenza del reperto obiettivo, in sede ileo-pelvica sn strettamente a ridosso del piano vertebrale,si evidenzia una neoformazione ovoidale, lievemente bernoccoluta, discretamente delimitabile. Misura mm 70 mm (longitudinale) (il 17 dicembre 1998 80 mm) x 40 mm… Ha ecostruttura solida e disomogenea per la presenza di innumerevoli ecoriflessioni di tipo microcalcifico isolate in ammassi. Al color-doppler, ostacolato dalla irrequietezza del piccolo paziente, si evidenziano alcuni vasi intralesionali con basso indice di resistenza. Nulla da segnalare a carico dei reni e degli organi parenchimatosi dell’alto addome…”.
La terapia venne aggiornata dal professor Di Bella il giorno 12 marzo 1999 portando la dose giornaliera di Somatostatina, dai 0,25 mg. giornalieri iniziali, a 0,5 mg. a giorni alterni per 3 volte la settimana, continuando con 0,25 mg gli altri 4 giorni della settimana, e lasciando invariato il resto.
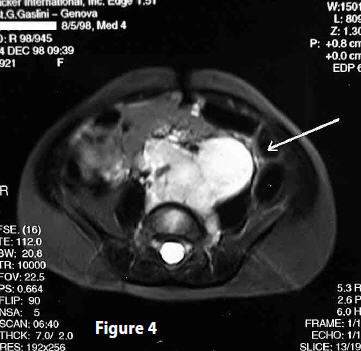
A sei mesi dall’inizio della terapia, una MRI effettuata il 18 giugno 1999 evidenziava una regressione di circa il 50%.
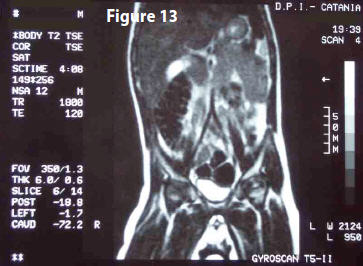
MRI (18 giugno 1999) Referto: “… L’indagine è stata condotta con tecnica turbo- spin-echo, secondo i piani assiale, coronale, con sequenze inversion-recovery e T2 pesate e dopo introduzione e.v. di gadolinio. A confronto con la precedente analoga indagine del 24 dicembre 1998, si apprezza una notevole riduzione di volume della neoformazione retroperitoneale della regione paraortica e paravertebrale di sinistra, che in atto misura 5 cm. (longitudinale) e 2 cm. (laterale). Indenni il fegato, milza, pancreas, reni, surreni”. (Fig 4)
Contemporaneamente VES, LDH, Ferritina, NSE, l’escrezione urinaria di ac Vanilmandelico, di Ac Omovanillico e Catecolamine erano completamente rientrate nei limiti fisiologici.
Dopo un anno di cura, il 21 gennaio 2000, una Risonanza Magnetica effettuata a Catania, evidenziava una pressoché totale scomparsa del Neuroblastoma.
MRI (21 gennaio 2000) Referto: “… L’indagine MRI è stata eseguita con tecnica spin-echo, secondo il piano assiale e coronale, con sequenze inversion recovery e T2 pesate e dopo introduzione e.v. di gadolinio. A confronto con la precedente analoga indagine del 18 giugno 99, si apprezza una pressoché totale scomparsa della neoformazione retroperitoneale già apprezzata in paraortica e paravertebrale di sinistra, in atto rappresentata da un piccolo residuo in paraortica. Invariato il restante reperto”. (Fig 5)
Nel settembre 2000 (età del bimbo: 28 mesi) dal professor Di Bella veniva così aggiornata la terapia:
1) Soluzione di:
Acido Tutto-Trans Retinoico gr 0,5
Axeroftolo palmitato gr 0,5
Betacarotene gr 2
Alfatocoferile acetato gr 1000
Un cucchiaino da caffè con 2,5 ml di Soluzione tre volte al dì, mattino- mezzodì - sera (almeno 15 minuti prima del pasto)
insieme a:
2) Diidrotachisterolo (4 gocce nel cucchiaino per ogni somministrazione).
e i seguenti prodotti per bocca durante il pasto:
3) Bromocriptina compresse da 2,5 mg (1/2 compressa, 2 volte al dì)
4) Melatonina 12%, Adenosina 51%, Glicina 37% compresse da 2 mg.
(2 compresse mattino e mezzodì, 4 prima di coricarsi)
5) Somatostatina 14 aminoacidi (mg 0,75 lentamente sottocute tutte le sere).
Dal 2001 fu aumentato il dosaggio della Somatostatina portandolo a 1 mg tutte le sere, lasciando il resto invariato. Nel marzo 2001 una MRI con MDC evidenziava “la totale assenza di tracce tumorali”. La terapia fu ulteriormente ridotta eliminando definitivamente Ciclofosfamide, Bromocriptina, Condroitinsolfato, Calcio. Fu ridotto il dosaggio della Somatostatina portandolo ad 1 mg sottocute a giorni alterni 3 volte la settimana. Dal 2002 si limitò la somministrazione di Somatostatina a 1 mg la settimana, dal 2003 1 mg ogni 15 giorni, fu sospesa del tutto nel 2007, mentre fino ad oggi continua la somministrazione al mattino a digiuno del composto di retinoidi con 8 gocce di Vit. D3 (Diidrotachisterolo), e quattro compresse di MLT da 2 mg dopo cena. Dal marzo 2001 tutti i successivi esami, sia emato-chimici che strumentali (PET, MRI), hanno confermato assenza di malattia con remissione completa del NBL.
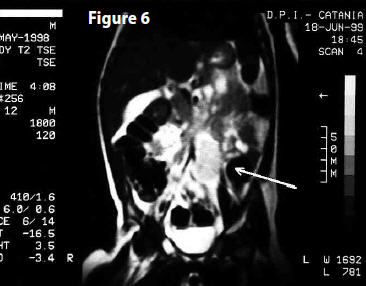
PET (7 ottobre 2003) Referto: “Assenza di aree di patologico accumulo del tracciante metabolico… Lo studio PET non mette in evidenza alterazioni riferibili a presenza di malattia sostitutiva dotata di elevata attività metabolica”. (Fig 6)
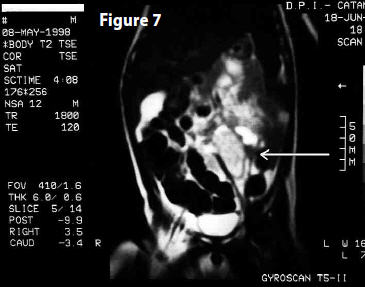
PET (20 settembre 2004) Referto: “Non evidenza di aree di patologico accumulo di tracciante metabolico. Lo studio PET non mette in evidenza alterazioni riferibili a presenza di malattia sostitutiva dotata di attività metabolica elevata” (Fig 7)
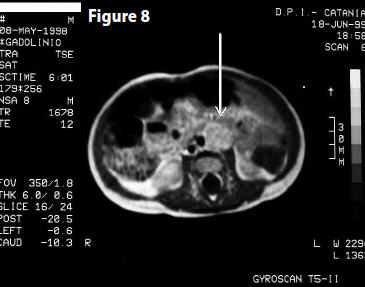
MRI (6 ottobre 2005) Referto: “… Si dimostra in atto una completa regressione macroscopica della nota lesione espansiva neoplastica localizzata nel retro peritoneo para-vasale addomino-pelvico ed inglobante i vasi iliaci di sinistra…” (Fig 8)
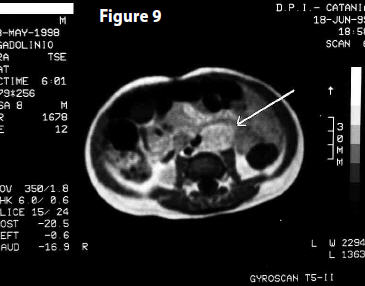
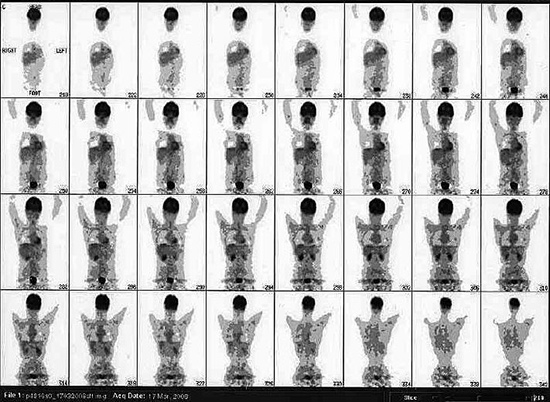
PET (17 marzo 2008) Referto: “Il controllo PET odierno, eseguito in follow-up, confrontato con i precedenti del 2003 e 2004, non evidenzia aree di patologico accumulo del tracciante metabolico nell’intera area esplorata. In particolare nulla da rilevare a carico dell’addome…” (Fig 9)
Discussion
La terapia biologica neuro-immuno-endocrina del professor Luigi Di Bella (MDB) in quattordici mesi ha ottenuto una risposta obiettiva completa, in assenza di tossicità, attraverso un meccanismo d’azione recettoriale, differenziante, apoptotico e antiproliferativo, con criteri, modalità e meccanismi d’azione totalmente difformi dalle consuete terapie citotossiche e citolitiche, dimostrando di potersi sostituire all’intervento chirurgico, e alla radioterapia e/o chemioterapia che comunque non sono in grado di dare risultati paragonabili alla chirurgia, ma eventualmente la precedono e/o la seguono.
Rationale of the Therapy
L’espressione recettoriale ubiquitaria della Prolattina e del GH (De Souza et al, l974; Hooghe et al, 1998; Tada et al 1999; Ben-Jonathan et al, 2002) rappresenta uno degli aspetti del ruolo mitogeno diretto e generalizzato di queste molecole. L’impiego della SST e/o Octreotide in tutte le patologie neoplastiche è ampiamente giustificato dalla regolazione negativa del GH, ormone di elevata potenzialità mitogena, dei fattori di crescita mitogeni GH–correlati, e dell’angiogenesi neoplastica. Per queste ragioni l’impiego della somatostatina e analoghi, trova indicazione in ogni neoplasia (Di Bella et al, 1979; Manni et al, 1989; Klijn et al, 1996; Pollak et al, 1997; Pawlikowski et al, 1998; Lachowicz-Ochedalska et al, 2000; Friend et al, 2000; Schally et al 2001; Schally et al, 2003; Massa al, 2004; Arena et al, 2007; Guillermet-Guibert et al, 2007; Lee et al, 2008) con particolare efficacia nei tumori neuroendocrini come il NBL caratterizzati da elevata espressione recettoriale per la somatostatina (Moertel et al, 1994; Sestini et al, 1996; Kogner et al, 1997; Briganti et al, 1997; Borgström, 1999; Friend et al, 2000; Steták et al, 2001; Orlando et al 2001; Florio et al, 2008). Gli SSTR sono stati individuati anche in un’ampia gamma di neoplasie non neuroendocrine (Schaer et al, 1997; Van Eijck et al, 1998; Held-Feindt et al, 1999; Mishima et al, 1999; Pinzani et al, 2001; Watson et al, 2001; Barnett et al, 2003). E’ dimostrato il rapporto causale tra espressione recettoriale del GH (di cui la SST è l’antitodo biologico) e induzione e progressione tumorale, (Zeitler et al, 2000) rilevando istochimicamente concentrazioni di GHR nettamente superiori nei tessuti tumorali, rispetto ai sani. E’ pertanto noto e documentato, il potente ruolo mitogeno del GH con indice proliferativo e velocità di progressione delle popolazioni neoplastiche direttamente proporzionale all’espressione recettoriale del GH (Lincoln et al, 1998). La perdita di differenziazione e la proliferazione incontrollata, anche se in misura diversa, sono denominatori comuni a tutte le neoplasie. Gli altri componenti del Metodo Di Bella attraverso un meccanismo sinergico fattoriale differenziante e antiproliferativo potenziano l’attività antitumorale della SST.
Interazione del Metodo Di Bella con gli aspetti citogenetici e molecolari del NBL
Nei NBL la perdita di eterozigoti 1 P, ( 1P LOH,) si associa ad amplificazione dell’oncogeno N- MIC, che non è accertata solo nel 3% di casi. E’ documentata l’inibizione di vari oncogeni, tra cui MIC da parte dei componenti del Metodo Di Bella (Degli Uberti et al, 1991; Peverali et al, 1996; Sun et al, 2002; Gumireddy et al, 2003; Durand et al, 2008; Aktas et al, 2009). I danni cromosomici del NBL comportano in varia misura inattivazioni di geni oncosoppressori: CD 44, Bcl-2, P53, oltre che delle Caspasi 3-8, elementi chiave della cascata apoptotica. L’inattivazione degli oncosoppressori avviene contemporaneamente alla amplificazione di oncogeni come il gene N-myc e il proto oncogene TRK considerati una delle cause citogenetiche del neuroblastoma. Anche la regolazione negativa degli oncosopressori è antagonizzata da componenti del MDB come l’Ac retinoico che inibisce l’inattivazione delle caspasi (Piedrafita 1997; Takada et al. 2001; Jiang et al. 2008) e la MLT che preserva dalla degradazione il P53.e Bcl-2 (Mediavilla et al 1999). Tra i fattori patogenetici del NBL anche l’alterata risposta dei neuroblasti allo stimolo differenziante efficamente contrastata dai retinoidi che inducono differenziatione neuronale: (Hassan et al 1990; Giannini et al 1997; Peverali et al 1998; Voigt et al 2000, Ueda et al, 2001; Kulikov et al 2007; Beijersbergen et al 2009; Wu et al 2009; Witzigmann et al 2008). La differenziazione è potenziata sinergicamente da altri componenti del Metodo Di Bella come MLT (Cos et al 1996; Garcia-Santos et al 2006; et al 2007), Vit D3 (Lange et al 2007) Vit E (Turley et al 1995; Swettenham et al 2005) Vit C (Carosio et al 2007) condroitinsolfato (Batra et al 1997; Pumphrey et al 2002).
Nel NBL si verifica l’alterazione del sistema recettore - ligando, NGF-TRK, costituito dall’interazione tra famiglie di recettori transmembrana ad attività tirosinchinasica TRK A-B-C, e ligandi costituiti da sistemi di trofismo e accrescimento del sistema nervoso centrale e periferico, rappresentati dal fattore di crescita del tessuto nervoso, (NGF), da neurotrofine (NT3-4-5), e dal Brain Derived Neurotrophic Factor (BDNF).
Componenti del MDB come la STT, retinoidi (Giannini et al, 1997; Witzigmann et al 2008; Liang et al 2008) antagonizzano la spinta proliferativi di queste molecole. Il legame di NGF, NT, BDNF con recettori TRK induce la transattivazione e la fosforilazione di residui tirosinici con inizio di una cascata di eventi intracellulari finalizzati alla proliferazione cellulare. Nelle cellule del neuroblastoma sono presenti vari livelli di espressione dei recettori tirosinkinasici. L’attività Protein-Tirosinchinasica è efficacemente inibita dalla SST e analoghi (Reardon 1996 et al; Pawlikowski et al 1998; Lachowicz-Ochedalska et al 2000; Cattaneo et al 2000; Florio et al 2001; Massa et al 2004; Lee et al 2008; Florio et al 2007). Il corrispettivo molecolare degli aspetti clinico-prognostici sarebbe regolato nei NBL più aggressivi dall’espressione ridotta o assente di TRK -A, elevata di TRK-B e amplificazione di N- Myc negativamente regolato dalla SST, (Degli Uberti et al 1991; Sun 2002 et al; Durand et al 2008 ). Nei NBL a prognosi peggiore si verifica espressione genica carente o assente per CD44, TRK-A, presente per MRP, insieme ad elevata attività telomerasica. Al contrario, il decremento di TRK-B,di N- Myc, unitamente all’incremento dell’espressione di TRK-A, sarebbe collegato ad una prognosi favorevole, così come un’elevata espressione di recettori per la somatostatina (sempre presenti nei NBL).
Meccanismi d’azione molecolari antiblastici del Metodo Di Bella
La proliferazione cellulare è strettamente dipendente dalla Prolattina, dal GH, massimo fattore di crescita, e da molecole mitogene GH dipendenti, da esso positivamente regolate, come EGF, FGF, HGF, IGF1-2, NGF, PDGF, VEGF, TGF, oltre che da fattori di crescita prodotti dall’apparato gastrointestinale, come Gastrina, VIP, CCK, anch’essi negativamente regolati dalla SST (Kath et al, 2000). Sia la proliferazione cellulare fisiologica che neoplastica avvengono per mezzo di queste stesse molecole, che la cellula neoplastica utilizza in misura esponenziale rispetto a quella sana. Antidoti biologici del GH, come Somatostatina e analoghi, non riducono solo l’espressione e la trascrizione di fattori di crescita altamente mitogeni, come IGF1-2 (Sall et al, 2004), EGF (Szepesházi et al, 1999), FGF (Held-Feindt et al 1999), ma estendono la loro regolazione negativa ai rispettivi recettori con evidenti riflessi antiproliferativi, (Mishima et al 1999) e antiangiogenici (Barrie et al, 1993; Albini et al 1999; Vidal et al 2000; Watson et al, 2001;.Bocci et al 2007).
E’noto come l’asse GH-IGF1 abbia una determinante influenza sullo sviluppo biologico neoplastico (Murray et al 2004). Gli IGFR rispondono mitogenicamente a IGF. L’effetto soppressivo della SST e analoghi sui livelli sierici di IGF1, è sia diretto, attraverso l’inibizione del gene di IGF, che indiretto, mediante la soppressione del GH e pertanto della sua induzione epatica di IGF1 (Sall et al 2004).
E’ ampiamente documentato e noto che la progressione neoplastica è strettamente dipendente dall’angiogenesi che ne rappresenta una fase obbligata ed essenziale. La Somatostatina e analoghi regolano negativamente tutte le fasi dell’angiogenesi, come la cascata dei monociti, (Wiedermann et al, 1993); l’interleukina 8, la Prostaglandina E 2, l’Ossico-Nitrico-Sintasi endoteliale (e-Nos) (Florio et al, 2003) oltre ai fattori di crescita il cui sinergismo è essenziale per l’angiogenesi stessa, come il VEGF (Cascinu et al, 2001; Mentlein et al, 2001)
TGF, IGF1 (Murray et al, 2004; Hagemeister et al, 2008) FGF, HGF (Jia et al, 2003; Hagemeister et al 2008), PDGF (Cattaneo et al, 1999), EGF (Mishima et al, 1999; Szepesházi et al, 1999; Held-Feindt et al, 1999). L’inibizione dell’angiogenesi indotta dalla SST è sinergicamente e fattorialmente potenziata dagli altri componenti del MDB quali: MLT (Lissoni et al 2001), retinoidi (Majewski et al, 1994; McMillan K. et al,1999; Kini et al, 2001), vitamina D3 (Kisker et al, 2003; Mantell et al, 2000), Vitamina E (Shklar et al, 1996; Tang et al , 2001), Vitamina C (Ashino et al, 2003), inibitori prolattinici (Turner et al, 2000), componenti della matrice extracellulare (Ozerdem et al, 2004; Liu et al, 2005).
Ugualmente l’effetto citostatico, antiproliferativo, antimetastatico della Somatostatina (Kogner et al 1997; Orlando et al 2001; Arena et al 2006; Guillermet-Guibert et al 2007; Barbieri et al 2008) è efficacemente sinergizzato dagli altri componenti del Metodo Di Bella come retinoidi (Hassan et al 1990; Onogi et al, 1998; Piedrafita et al, 1997; Voigt et al, 2000; Witzigmann et al, 2008), MLT (Kvetnoĭ et al, 1986; Maestroni et al, 1996; Cos et al 1996; Bartsch et al, 1999; Mediavilla et al, 1999; Cos et al, 2000 García-Santos et al 2006; Pizarro et al 2008) Vit D3 (Celli et al, 1999; Barroga et al 2000; Campbell et al 2000; Jensen et al 2001; Stio et al, 2001), gli inibitori prolattinici Cabergolina e Bromocriptina (Manni et al, 1989; Klijn et al, 1996; Gruszka et al, 2001), Galattosamina solfato, componenti della matrice extracellulare (Batra et al 1997; Pumphrey et al, 2002),Vit E (Turley et al, 1995; Shklar et al, 1996; Israel et al, 2000; Malafa et al 2002; Neuzil et al 2002) Vit C (Cameron et al, 1979; Murata et al 1982; Head et al 1998; Carosio et al 2007). La letteratura ha pertanto confermato i sinergici meccanismi d’azione antineoplastici differenzianti antiproliferativi, antiangiogenetici e antimetastatici di tutti i componenti del Metodo Di Bella.
Il risultato obiettivo, in assenza di tossicità, mediante la rapida riduzione fino alla scomparsa di una massa retro peritoneale di cm 4x8 in un bimbo di sette mesi, insieme al blocco di ogni disseminazione metastatica, e l’assenza di malattia da oltre 10 anni, evidenzia l’efficacia di questa terapia ed è conforme ai positivi risultati conseguiti dall’uso del Metodo Di Bella nelle malattie linfoproliferative (Todisco et al 2001; Todisco et al ,2006; Todisco et al 2009), carcinomi polmonari al 3° e 4°, (Norsa et al 2006; Norsa et 2007) carcinomi della mammella (Di Bella et al, 2008), e degli epiteli aerodigestivi superiori (Di Bella et al, 2009). Il MDB, senza necessità di ricovero ospedaliero e neppure di day hospital, senza pregiudicare minimamente lo sviluppo psicofisico del bimbo, ha evitato un intervento chirurgico difficilmente radicale e comunque ad alto rischio perché l’aorta, la vena cava distali, la biforcazione e le arterie e vene iliache, erano inglobate dalla massa neoplastica e dislocate. Ha inoltre consentito di evitare chemio e radioterapia con le note e gravi controindicazioni.
Gli esami ematochimici e la diagnostica strumentale hanno evidenziato una progressiva e contemporanea riduzione del volume della neoplasia unitamente al decremento dei metaboliti delle amine del sistema adrenergico tipici del neuroblastoma, come catecolamine, ac vanil mandelico, omovanillico, insieme a marcatori neuroendocrini come NSE, e molecole come Ferritina e HDL tipiche di questa patologia. Il risultato obiettivo completo in poco più di 1 anno, insieme al blocco di ogni disseminazione metastatica, frequente nel NBL, evidenzia l’efficacia di questa terapia. La somministrazione continuativa per oltre 10 anni dei componenti del MDB ha dimostrato di essere perfettamente tollerata, consentendo un’omeostasi immunitaria e neuroendocrina perfettamente nei limiti fisiologici, e uno sviluppo psicofisico ottimale.
L’applicazione precoce e come terapia di prima linea del Metodo Di Bella pertanto, in un organismo non debilitato dagli effetti tossici, mutageni e immunodepressivi della chemio-radioterapia, ha grandemente facilitato il risultato. Riteniamo utile segnalare il caso per invitare ad un maggiore interesse, studio e approfondimento sulle possibilità aperte in oncologia dalla terapia immunoneuroendocrina, biologica e recettoriale del Metodo Di Bella.
Giuseppe Di Bella
e-mail: posta@giuseppedibella.it
Telefono 051 239662; 051 230369; fax 051 2961238
Via Marconi 51, 40122, Bologna
Fondazione Di Bella, Bologna
Istituto Rizzoli di Ricovero e Cura a Carattere scientifico, Bologna
1) Referenze
2) Albini A, Florio T, Giunciuglio D, Masiello L, Carlone S, Corsaro A, et al. Somatostatin controls Kaposi’s sarcoma tumor growth through inhibition of angiogenesis. FASEB J. 1999; 13(6): 647-655.
3) Arena S, Pattarozzi A, Massa A. An intracellular multi-effector complex mediates somatostatin receptor 1 activation of phospho-tyrosine phosphatase eta. Mol Endocrinol. 2007 Jan;21(1):229-46. Epub 2006 Oct 4.
4) Ashino H, Shimamura M, Nakajima H, Dombou M, Kawanaka S, Oikawa T, et al. Novel function of ascorbic acid as an angiostatic factor. Angiogenesis. 2003; 6(4): 259-269.
5) Aktas S, Altun Z, Erbayraktar N. Effect of Cytotoxic Agents and Retinoic Acid on Myc-N Protein Expression in Neuroblastoma. Appl Immunohistochem Mol Morphol. 2009 Jun 22.
6) Barbieri F, Pattarozzi A, Gatti M. Somatostatin receptors 1, 2, and 5 cooperate in the somatostatin inhibition of C6 glioma cell proliferation in vitro via a phosphotyrosine phosphatase-eta-dependent inhibition of extracellularly regulated kinase-1/2. Endocrinology. 2008 Sep;149(9):4736-46.
7) Barnett P. Somatostatin and somatostatin receptor physiology. Endocrine. 2003; 20(3): 255-264.
8) Barrie R, Woltering EA, Hajarizadeh H, Mueller C, Ure T, Fletcher WS. Inhibition of angiogenesis by somatostatin and somatostatin-like compounds is structurally dependent. J Surg Res. 1993; 55(4): 446-450.
9) Barroga EF, Kadosawa T, Okumura M, Fujinaga T. Inhibitory effects of 22-oxa-calcitriol and all- trans retinoic acid on the growth of a canine osteosarcoma derived cell-line in vivo and its pulmonary metastasis in vivo. Res Vet Sci. 2000; 68(1): 79-87.
10) Batra RK, Olsen JC, Hoganson DK, Caterson B, Boucher RC. Retroviral gene transfer is inhibited by chondroitin sulfate proteoglycans/glycosaminoglycans in malignant pleural effusions. J Biol Chem. 1997; 272(18): 11736-43.
11) Beijersbergen RL, Bernards R. ZNF423 is critically required for retinoic acid-induced differentiation and is a marker of neuroblastoma outcome. Cancer Cell. 2009 Apr 7;15(4):328-40.
12) Ben-Jonathan N, Liby K, McFarland M, Zinger M. Prolactin as an autocrine/paracrine growth factor in human cancer. Trends Endocrinol Metab. 2002; 13(6):245-250.
13) Bocci G, Culler MD, Fioravanti A. In vitro antiangiogenic activity of selective somatostatin subtype-1 receptor agonists. Eur J Clin Invest. 2007 Sep;37(9):700-8.
14) Borgström P, Hassan M, The somatostatin analogue octreotide inhibits neuroblastoma growth in vivo.Pediatr Res. 1999 Sep;46(3):328-32.
15) Briganti V, Sestini R, Orlando C. Imaging of somatostatin receptors by indium-111-pentetreotide correlates with quantitative determination of somatostatin receptor type 2 gene expression in neuroblastoma tumors. Clin Cancer Res. 1997 Dec;3(12 Pt 1):2385-91.
16) Cameron E, Pauling L, Leibovitz B. Ascorbic acid and cancer: a review. Cancer Res. 1979; 39(3): 663-681.
17) Campbell MJ, Gombart AF, Kwok SH, Park S, Koeffler HP. The anti-proliferative effects of 1alpha, 25(OH)2D3 on breast and prostate cancer cells are associated with induction of BRCA1 gene expression. Oncogene. 2000; 19(44): 5091-7.
18) Carosio R, Zuccari G, Orienti I. Sodium ascorbate induces apoptosis in neuroblastoma cell lines by interfering with iron uptake. Mol Cancer. 2007 Aug 30;6:55.
19) Cascinu S, Del Ferro E, Ligi M, Staccioli MP, Giordani P, Catalano V, et al. Inhibition of vascular endothelial growth factor by octreotide in colorectal cancer patients. Cancer Invest. 2001; 19(1): 8-12.
20) Cattaneo MG, Taylor JE, Culler MD Selective stimulation of somatostatin receptor subtypes: differential effects on Ras/MAP kinase pathway and cell proliferation in human neuroblastoma cells. FEBS Lett. 2000 Sep 22;481(3):271-6.
21) Cattaneo MG, Scita G, Vicentini LM. Somatostatin inhibits PDGF-stimulated Ras activation in human neuroblastoma cells.FEBS Lett. 1999 Oct 1;459(1):64-8.
22) Celli A, Treves C, Nassi P, Role of 1,25-dihydroxyvitamin D3 and extracellular calcium in the regulation of proliferation in cultured SH-SY5Y human neuroblastoma cells. Neurochem Res. 1999 May;24(5):691-8.
23) Cos S, Sánchez-Barceló EJ. Melatonin and mammary pathological growth. Front Neuroendocrinol. 2000; 21(2): 133-170.
24) Cos S, Verduga R, Fernández-Viadero C, Effects of melatonin on the proliferation and differentiation of human neuroblastoma cells in culture. Neurosci Lett. 1996 Sep 27;216(2):113-6.
25) De Souza I, Morgan L, Lewis UL, Raggatt PR, Salih H, Hobbs JR. Growth-hormone dependence among human breast cancers. Lancet. 1974; 2(7874):182-184.
26) Degli Uberti EC, Hanau S, Rossi R. Somatostatin reduces 3H-thymidine incorporation and c-myc, but not thyroglobulin ribonucleic acid levels in human thyroid follicular cells in vitro., J Clin Endocrinol Metab. 1991 Jun;72(6):1364-71.
27) Di Bella L, Rossi MT, Scalera G. Perspectives in pineal functions. Prog Brain Res. 1979; 52: 475-478.
28) Di Bella L, Gualano L. Key aspects of melatonin physiology: thirty years of research. Neuro Endocrinol Lett. 2006; 27(4): 425-432.
29) Durand A, Champier J, Jouvet A, Labrousse F, Honnorat J, Guyotat J, Fèvre-Montange M. Expression of c-Myc, neurofibromatosis Type 2, somatostatin receptor 2 and erb-B2 in human meningiomas: relation to grades or histotypes. Clin Neuropathol. 2008 Sep-Oct;27(5):334-45.
30) Florio T, Morini M, Villa V, Arena S, Corsaro A, Thellung S, et al. Somatostatin inhibits tumor angiogenesis and growth via somatostatin receptor-3-mediated regulation of endothelial nitric oxide synthase and mitogen-activated protein kinase activities. Endocrinology. 2003; 144(4): 1574-1584.
31) Florio T. Molecular mechanisms of the antiproliferative activity of somatostatin receptors (SSTRs) in neuroendocrine tumors. Front Biosci. 2008 Jan 1;13:822-40. Review.
32) Florio T, Thellung S, Arena S. Somatostatin receptor 1 (SSTR1)-mediated inhibition of cell proliferation correlates with the activation of the MAP kinase cascade: role of the phosphotyrosine phosphatase SHP-2. J Physiol Paris. 2000 May-Aug;94(3-4):239-50. Review.
33) Florio T. Somatostatin/somatostatin receptor signalling: phosphotyrosine phosphatases. Mol Cell Endocrinol. 2008 May 14;286(1-2):40-8. Epub 2007 Aug 31. Review.
34) Florio T, Arena S, Thellung. The activation of the phosphotyrosine phosphatase eta (r-PTP eta) is responsible for the somatostatin inhibition of PC Cl3 thyroid cell proliferation. Mol Endocrinol. 2001 Oct;15(10):1838-52.
35) Friend KE.Targeting the growth hormone axis as a therapeutic strategy in oncology.Growth Horm IGF Res. 2000 Apr;10 Suppl A:S45-6. Review.
36) García-Santos G, Antolín I, Herrera F. Melatonin induces apoptosis in human neuroblastoma cancer cells. J Pineal Res. 2006 Sep;41(2):130-5.
37) Giannini G, Dawson MI, Zhang X,. Activation of three distinct RXR/RAR heterodimers induces growth arrest and differentiation of neuroblastoma cells. J Biol Chem. 1997 Oct 17;272(42):26693-701.
38) Gruszka A, Pawlikowski M, Kunert-Radek J. Anti-tumoral action of octreotide and bromocriptine on the experimental rat prolactinoma: anti-proliferative and pro-apoptotic effects. Neuro Endocrinol Lett. 2001; 22(5): 343-348.
39) Gumireddy K, Reddy GS, Ikegaki N. Anti-proliferative effects of 20-epi-vitamin-D3 analogue, KH1060 in human neuroblastoma: induction of RAR-beta and p21(Cip1). Cancer Lett. 2003 Feb 10;190(1):51-60.
40) Guillermet-Guibert J, Saint-Laurent N, Davenne L. Novel synergistic mechanism for sst2 somatostatin and TNFalpha receptors to induce apoptosis: crosstalk between NF-kappaB and JNK pathways. Cell Death Differ. 2007 Feb;14(2):197-208.
41) Hagemeister AL, Sheridan MA. Somatostatin inhibits hepatic growth hormone receptor and insulin-like growth factor I mRNA expression by activating the ERK and PI3K signaling pathways. Am J Physiol Regul Integr Comp Physiol. 2008 Aug;295(2):R490.
42) Hassan HT, Rees J. Triple combination of retinoic acid plus actinomycin D plus dimethylformamide induces differentiation of human acute myeloid leukaemic blasts in primary culture. Cancer Chemother Pharmacol. 1990; 26(1): 26-30.
43) Head KA. Ascorbic acid in the prevention and treatment of cancer. Altern Med Rev. 1998; 3(3): 174-186.
44) Held-Feindt J, Krisch B, Mentlein R. Molecular analysis of the somatostatin receptor subtype 2 in human glioma cells. Brain Res Mol Brain Res. 1999; 64(1): 101-7.
45) Hooghe R, Merchav S, Gaidano G, Naessens F, Matera L. A role for growth hormone and prolactin in leukaemia and lymphoma? Cell Mol Life Sci. 1998; 54(10): 1095-1101.
46) Israel K, Yu W, Sanders BG, Kline K. Vitamin E succinate induces apoptosis in human prostate cancer cells: role for Fas in vitamin E succinate-triggered apoptosis. Nutr Cancer. 2000; 36(1): 90-100.
47) Jensen SS, Madsen MW, Lukas J, Binderup L, Bartek J. Inhibitory effects of 1alpha,25-dihydroxyvitamin D(3) on the G(1)-S phase-controlling machinery. Mol Endocrinol. 2001; 15(8): 1370-1380.
48) Jia WD, Xu GL, Xu RN, Sun HC, Wang L, Yu JH, et al. Octreotide acts as an antitumor angiogenesis compound and suppresses tumor growth in nude mice bearing human hepatocellular carcinoma xenografts. J Cancer Res Clin Oncol. 2003; 129(6): 327-334.
49) Jiang M, Zhu K, Grenet J, Lahti JM. Retinoic acid induces caspase-8 transcription via phospho-CREB and increases apoptotic responses to death stimuliin neuroblastoma cells. Biochim Biophys Acta. 2008 Jun;1783(6):1055-67.
50) Kath R, Höffken K. The significance of somatostatin analogues in the antiproliferative treatment of carcinomas. Recent Results Cancer Res. 2000; 153: 23-43.
51) Kini AR, Peterson LA, Tallman MS, Lingen MW. Angiogenesis in acute promyelocytic leukemia: induction by vascular endothelial growth factor and inhibition by all-trans retinoic acid. Blood. 2001; 97(12): 3919-3924.
52) Kisker O, Onizuka S, Becker CM, Fannon M, Flynn E, D'Amato R, et al. Vitamin D binding protein-macrophage activating factor (DBP-maf) inhibits angiogenesis and tumor growth in mice. Neoplasia. 2003; 5(1): 32-40.
53) Klijn JG, Setyono-Han B, Bontenbal M, Seynaeve C, Foekens J. Novel endocrine therapies in breast cancer. Acta Oncol. 1996; 35 Suppl 5: 30-37.
54) Kogner P, Borgström P, Bjellerup P Somatostatin in neuroblastoma and ganglioneuroma, Eur J Cancer. 1997 Oct;33(12):2084-9.
55) Kvetnoĭ IM, Levin IM. Melatonin and tumor growth. (In Russian with English abstract). Eksp Onkol. 1986; 8(4): 11-15.
56) Kulikov AV, Rzhaninova AA, Goldshtein DV. Expression of NMDA receptors in multipotent stromal cells of human adipose tissue under conditions of retinoic acid-induced differentiation. Bull Exp Biol Med. 2007.
57) Lachowicz-Ochedalska A, Rebas E, Kunert-Radek J. Effects of somatostatin and its analogues on tyrosine kinase activity in rodent tumors. Biol Signals Recept. 2000 Sep-Oct;9(5):255-9.
58) Lange TS, Singh RK, Kim KK, 1: Anti-proliferative and pro-apoptotic properties of 3-bromoacetoxy calcidiol in high-risk neuroblastoma. Chem Biol Drug Des. 2007 Oct;70(4):302-10.
59) Lee LT, Schally AV, Liebow C. Dephosphorylation of cancer protein by tyrosine phosphatases in response to analogs of luteinizing hormone-releasing hormone and somatostatin. Anticancer Res. 2008 Sep-Oct;28(5A):2599-605.
60) Liang Y, Li QF, Zhang XY,. Differential expression of nuclear matrix proteins during the differentiation of human neuroblastoma SK-N-SH cells induced by retinoic acid. J Cell Biochem. 2009 Apr 1;106(5):849.
61) Lincoln DT, Sinowatz F, Temmim-Baker L, Baker HI, Kölle S, Waters MJ. Growth hormone receptor expression in the nucleus and cytoplasm of normal and neoplastic cells. Histochem Cell Biol. 1998; 109(2): 141-159.
62) Lissoni P, Rovelli F, Malugani F, Bucovec R, Conti A, Maestroni GJ. Anti-angiogenic activity of melatonin in advanced cancer patients. Neuro Endocrinol Lett. 2001; 22(1): 45-47.
63) Liu Y, Yang H, Otaka K, Takatsuki H, Sakanishi A. Effects of vascular endothelial growth factor (VEGF) and chondroitin sulfate A on human monocytic THP-1 cell migration. Colloids Surf B Biointerfaces. 2005; 43(3-4): 216-220.
64) Maestroni GJ, Hertens E, Galli P, Conti A, Pedrinis E. Melatonin-induced T-helper cell hematopoietic cytokines resembling both interleukin-4 and dynorphin. J Pineal Res. 1996; 21(3): 131-9.
65) Majewski S, Szmurlo A, Marczak M, Jablonska S, Bollag W. Synergistic effect of retinoids and interferon alpha on tumor-induced angiogenesis: anti-angiogenic effect on HPV-harboring tumor-cell lines. Int J Cancer. 1994; 57(1): 81-85.
66) Malafa MP, Fokum FD, Smith L, Louis A. Inhibition of angiogenesis and promotion of melanoma dormancy by vitamin E succinate. Ann Surg Oncol. 2002; 9(10): 1023-1032.
67) Manni A, Boucher AE, Demers LM, Harvey HA, Lipton A, Simmonds MA, et al. Endocrine effects of combined somatostatin analog and bromocriptine therapy in women with advanced breast cancer. Breast Cancer Res Treat. 1989; 14(3): 289-298.
68) Mantell DJ, Owens PE, Bundred NJ, Mawer EB, Canfield AE. 1 alpha,25-dihydroxyvitamin D(3) inhibits angiogenesis in vitro and in vivo. Circ Res. 2000; 87(3): 214-220.
69) Massa A, Barbieri F, Aiello C. The expression of the phosphotyrosine phosphatase DEP-1/PTPeta dictates the responsivity of glioma cells to somatostatin inhibition of cell proliferation. J Biol Chem. 2004 Jul 9; 279(28):29004-12.
70) McMillan K, Perepelitsyn I, Wang Z, Shapshay SM. Tumor growth inhibition and regression induced by photothermal vascular targeting and angiogenesis inhibitor retinoic acid. Cancer Lett. 1999; 137(1): 35-44.
71) McMillan CR, Sharma R, Ottenhof T. Modulation of tyrosine hydroxylase expression by melatonin in human SH-SY5Y neuroblastoma cells. Neurosci Lett. 2007 Jun 4;419(3):202-6.
72) Mediavilla MD, Cos S, Sánchez-Barceló EJ. Melatonin increases p53 and p21WAF1 expression in MCF-7 human breast cancer cells in vitro. Life Sci. 1999; 65(4): 415-420.
73) Mentlein R, Eichler O, Forstreuter F, Held-Feindt J. Somatostatin inhibits the production of vascular endothelial growth factor in human glioma cells. Int J Cancer. 2001; 92(4): 545-550.
74) Mishima M, Yano T, Jimbo H, Yano N, Morita Y, Yoshikawa H, et al. Inhibition of human endometrial cancer cell growth in vitro and in vivo by somatostatin analog RC-160. Am J Obstet Gynecol. 1999; 181(3): 583-590.
75) Moertel CL, Reubi JC, Scheithauer BS. Expression of somatostatin receptors in childhood neuroblastoma. Am J Clin Pathol. 1994 Dec;102(6):752-6.
76) Murata A, Morishige F, Yamaguchi H. Prolongation of survival times of terminal cancer patients by administration of large doses of ascorbate. Int J Vitam Nutr Res Suppl. 1982; 23: 103-113.
77) Murray RD, Kim K, Ren SG. Central and peripheral actions of somatostatin on the growth hormone-IGF-I axis. J Clin Invest. 2004 Aug;114(3):349-56.
78) Neuzil J, Kagedal K, Andera L, Weber C, Brunk UT. Vitamin E analogs: a new class of multiple action agents with anti-neoplastic and anti-atherogenic activity. Apoptosis. 2002; 7(2): 179-87.
79) Norsa A, Martino V. Somatostatin, retinoids, melatonin, vitamin D, bromocriptine, and cyclophosphamide in advanced non-small-cell lung cancer patients with low performance status. Cancer Biother Radiopharm. 2006 Feb;21(1):68-73.
80) Norsa A, Martino V.Somatostatin, retinoids, melatonin, vitamin D, bromocriptine, and cyclophosphamide in chemotherapy-pretreated patients with advanced lung adenocarcinoma and low performance status.
Cancer Biother Radiopharm. 2007 Feb;22(1):50-5.
81) Onogi N, Okuno M, Matsushima-Nishiwaki R, Fukutomi Y, Moriwaki H, Muto Y, et al. Antiproliferative effect of carotenoids on human colon cancer cells without conversion to retinoic acid. Nutr Cancer. 1998; 32(1): 20-24.
82) Orlando C, Raggi CC, Bagnoni L. Somatostatin receptor type 2 gene expression in neuroblastoma, measured by competitive RT-PCR, is related to patient survival and to somatostatin receptor imaging by indium -111-pentetreotide. Med Pediatr Oncol. 2001 Jan;36(1):224-6.
83) Ozerdem U, Stallcup WB. Pathological angiogenesis is reduced by targeting pericytes via the NG2 proteoglycan. Angiogenesis. 2004; 7(3): 269-276.
84) Pawlikowski M, Lachowicz L, Kunert-Radek J. Differential effects of somatostatin and its analog on protein tyrosine kinases activity in the rat pituitary and the murine colonic tumors. Biochem Biophys Res Commun. 1998 May 19;246(2):375-7.
85) Peverali FA, Orioli D, Tonon L, Retinoic acid-induced growth arrest and differentiation of neuroblastoma cells are counteracted by N-myc and enhanced by max overexpressions. Oncogene. 1996 Jan18;12(2):457-62.
86) Piedrafita FJ, Pfahl M. Retinoid-induced apoptosis and Sp1 cleavage occur independently of transcription and require caspase activation. Mol Cell Biol. 1997; 17(11): 6348-58.
87) Pinzani P, Orlando C, Raggi CC, Distante V, Valanzano R, Tricarico C, et al. Type-2 somatostatin receptor mRNA levels in breast and colon cancer determined by a quantitative RT-PCR assay based on dual label fluorogenic probe and the TaqMan technology. Regul Pept. 2001; 99(2-3): 79-86.
88) Pizarro JG, Yeste-Velasco M, Esparza JL. The antiproliferative activity of melatonin in B65 rat dopaminergic neuroblastoma cells is related to the downregulation of cell cycle-related genes. J Pineal Res. 2008 Aug;45(1):8-16.
89) Pollak M. The potential role of somatostatin analogues in breast cancer treatment. Yale J Biol Med. 1997; 70(5-6): 535-539.
90) Pumphrey CY, Theus AM, Li S, Parrish RS, Sanderson RD. Neoglycans, carbodiimide-modified glycosaminoglycans: a new class of anticancer agents that inhibit cancer cell proliferation and induce apoptosis. Cancer Res. 2002; 62(13): 3722-8.
91) Reardon DB, Wood SL, Brautigan DL Activation of a protein tyrosine phosphatase and inactivation of Raf-1 by somatostatin., Biochem J. 1996 Mar 1;314 ( Pt 2):401-4.
92) Sall JW, Klisovic DD, O'Dorisio MS. Somatostatin inhibits IGF-1 mediated induction of VEGF in human retinal pigment epithelial cells. Exp Eye Res. 2004 Oct;79(4):465-76.
93) Sestini R, Orlando C, Peri A, Quantitation of somatostatin receptor type 2 gene expression in neuroblastoma cell lines and primary tumors using competitive reverse transcription-polymerase chain reaction. Clin Cancer Res. 1996 Oct;2(10):1757-65.
94) Schaer JC, Waser B, Mengod G, Reubi JC. Somatostatin receptor subtypes sst1, sst2, sst3 and sst5 expression in human pituitary, gastroentero-pancreatic and mammary tumors: comparison of mRNA analysis with receptor autoradiography. Int J Cancer. 1997; 70(5): 530-537.
95) Schally AV, Comaru-Schally AM, Nagy A, Kovacs M, Szepeshazi K, Plonowski A, et al. Hypothalamic hormones and cancer. Front Neuroendocrinol. 2001; 22(4): 248-291.
96) Schally AV, Nagy A. New approaches to treatment of various cancers based on cytotoxic analogs of LHRH, somatostatin and bombesin. Life Sci. 2003; 72(21): 2305-20.
97) Shklar G, Schwartz JL. Vitamin E inhibits experimental carcinogenesis and tumour angiogenesis. Eur J Cancer B Oral Oncol. 1996; 32B(2): 114-119.
98) Steták A, Lankenau A, Vántus T. The antitumor somatostatin analogue TT-232 induces cell cycle arrest through PKCdelta and c-Src. Biochem Biophys Res Commun. 2001 Jul 13;285(2):483-8.
99) Stio M, Celli A, Treves C. Synergistic anti-proliferative effects of vitamin D derivatives and 9-cis retinoic acid in SH-SY5Y human neuroblastoma cells. J Steroid Biochem Mol Biol. 2001 Jun;77(4-5):213-22.
100) Sun L, Fuselier JA, Murphy WA, Antisense peptide nucleic acids conjugated to somatostatin analogs and targeted at the n-myc oncogene display enhanced cytotoxity to human neuroblastoma IMR32 cells expressing somatostatin receptors. Peptides. 2002 Sep;23(9):1557-65.
101) Swettenham E, Witting PK, Salvatore BA, Neuzil J. Alpha-tocopheryl succinate selectively induces apoptosis in neuroblastoma cells: potential therapy of malignancies of the nervous system? J Neurochem. 2005 Sep;94(5):1448-56. Epub 2005 Jul 7.
102) Szepesházi K, Halmos G, Schally AV, Arencibia JM, Groot K, Vadillo-Buenfil M, et al. Growth inhibition of experimental pancreatic cancers and sustained reduction in epidermal growth factor receptors during therapy with hormonal peptide analogs. J Cancer Res Clin Oncol. 1999; 125(8-9): 444-452.
103) Tada M, Kobayashi H, Moriuchi T. Molecular basis of pituitary oncogenesis. J Neurooncol. 999;45(1):83-96. Review.
104) Takada N, Isogai E, Kawamoto T, A. Retinoic acid-induced apoptosis of the CHP134 neuroblastoma cell line is associated with nuclear accumulation of p53 and is rescued by the GDNF/Ret signal. Med Pediatr Oncol. 2001 Jan;36(1):122-6.
105) Tang FY, Meydani M. Green tea catechins and vitamin E inhibit angiogenesis of human microvascular endothelial cells through suppression of IL-8 production. Nutr Cancer. 2001; 41(1-2): 119-125.
106) Todisco M.Relapse of high-grade non-Hodgkin’s lymphoma after autologous stem cell transplantation: a case successfully treated with cyclophosphamide plus somatostatin, bromocriptine, melatonin, retinoids, and ACTH. Am J Ther. 2006 Nov-Dec;13(6):556-7.
107) Todisco M, Casaccia P, Rossi N.Cyclophosphamide plus somatostatin, bromocriptin, retinoids, melatonin and ACTH in the treatment of low-grade non-Hodgkin’s lymphomas at advanced stage: results of a phase II trial. Cancer Biother Radiopharm. 2001 Apr;16(2):171-7.
108) Todisco M. Chronic lymphocytic leukemia: long-lasting remission with combination of cyclophosphamide, somatostatin, bromocriptine, retinoids, melatonin, and ACTH. Cancer Biother Radiopharm. 2009 Jun;24(3):353-5.
109) Turley JM, Funakoshi S, Ruscetti FW, Kasper J, Murphy WJ, Longo DL, et al. Growth inhibition and apoptosis of RL human B lymphoma cells by vitamin E succinate and retinoic acid: role for transforming growth factor beta. Cell Growth Differ. 1995; 6(6): 655-663.
110) Turner HE, Nagy Z, Gatter KC, Esiri MM, Harris AL, Wass JA. Angiogenesis in pituitary adenomas - relationship to endocrine function, treatment and outcome. J Endocrinol. 2000; 165(2): 475-481.
111) Ueda K. Detection of the retinoic acid-regulated genes in a RTBM1 neuroblastoma cell line using cDNA microarray. Kurume Med J. 2001;48(2):159-64.
112) Van Eijck CH, Kwekkboom DJ, Krenning EP. Somatostatin receptors and breast cancer. Q J Nucl Med. 1998; 42(1): 18-25.
113) Vidal S, Oliveira MC, Kovacs K, Scheithauer BW, Lloyd R. Immunolocalization of vascular endothelial growth factor in the GH3 cell line. Cell Tissue Res. 2000; 300(1): 83-88.
114) Voigt A, Hartmann P, Zintl F. Differentiation, proliferation and adhesion of human neuroblastoma cells after treatment with retinoic acid. Cell Adhes Commun. 2000; 7(5): 423-440.
115) Watson JC, Balster DA, Gebhardt BM, O'Dorisio TM, O'Dorisio MS, Espenan GD, et al. Growing vascular endothelial cells express somatostatin subtype 2 receptors. Br J Cancer. 2001; 85(2): 266-272.
116) Wiedermann CJ, Reinisch N, Braunsteiner H. Stimulation of monocyte chemotaxis by human growth hormone and its deactivation by somatostatin. Blood. 1993; 82(3): 954-960.
117) Witzigmann H, Tröbs RB. All-trans retinoic acid arrests neuroblastoma cells in a dormant state. Subsequent nerve growth factor/brain-derived neurotrophic factor treatment adds modest benefit. J Pediatr Surg. 2008 Jul;43(7):1284-94.
118) Wu PY, Lin YC, Chang CL, Functional decreases in P2X7 receptors are associated with retinoic acid-induced neuronal differentiation of Neuro-2a neuroblastoma cells. Cell Signal. 2009 Jun;21(6):881-91.
119) Zeitler P, Siriwardana G.Stimulation of mitogen-activated protein kinase pathway in rat somatotrophs by growth hormone-releasing hormone. Endocrine. 2000 Jun;12(3):257-64.
|