|
|
|
|
|
|
|
Risposta obiettiva completa di un carcinoma squamo - cellulare dell’esofago a terapia biologica
Giuseppe Di Bella
20 Dicembre 2009
Abbreviazioni
Di Bella’s Method (MDB)
Magnetic Resonance Imaging (MRI)
Positron Emission Tomography (PET)
Growth Hormone (GH)
Epidermic Growth Factor (EGF)
Fibroblastic Growth Factor (FGF)
Insulin-like Growth Factor 1-2 (IGF1-2)
L’impiego sinergico di Somatostatina, Melatonina, Retinoidi, Vitamine
C, D3, E, Calcio, Amminoglucidi solforati, dosi minime di
ciclofosfamide per os, in un uomo di 70 anni con carcinoma esofageo
scarsamente differenziato inoperabile, hanno consentito, dall’inizio
della cura nel 1995, ad oggi, una qualità di vita eccellente, e la
guarigione con recupero funzionale.
Vengono discussi il razionale e i meccanismi d’azione molecolare della terapia, che esercita un effetto
antiproliferativo, differenziante, apoptotico, preservando ed esaltando, al contrario della chemio
e/o della radioterapia, sia il trofismo e la funzionalità di organi e tessuti, che l’omeostasi immunitaria e
antiblastica. Questo risultato, in assenza di tossicità, documenta
l’efficacia di questa multiterapia biologica (MDB) ed è conforme ai
positivi risultati già pubblicati sull’uso del MDB nei LNH a basso
grado e carcinomi polmonari al 3° e 4° stadio. Il MDB, senza necessità
di ricovero, in assenza di tossicità e senza ridurre minimamente
l’attività lavorativa, ha progressivamente e lentamente ridotto e poi
eliminato la massa tumorale, ottenendo una risposta obiettiva completa.
Riteniamo utile segnalare il caso per invitare ad un maggiore
interesse, studio e approfondimento sulle possibilità aperte in oncologia dalla terapia biologica e recettoriale del MDB.
Introduzione
Si presenta un caso di remissione completa (RC) con terapia biologica
(MDB) di un carcinoma esofageo monitorato dal 1995 ad oggi. Sono
riportati i componenti della terapia biologica MDB e una sintesi della
documentazione, prima e dopo il trattamento MDB.
Si descrive in estrema sintesi il razionale del MDB, documentandone le
basi scientifiche, i meccanismi d’azione di biologia molecolare, la
risposta clinica, il favorevole profilo tossicologico.
Il carcinoma esofageo
La prognosi nei pazienti con cancro dell’esofago è sfavorevole; meno
del 5% sopravvive a 5 anni (Harrison). L’escissione chirurgica di tutto
il tessuto neoplastico macroscopicamente visibile (resezione totale) è
possibile solo nel 45% dei casi, e si associa ad una rilevante
percentuale di complicazioni e/o mortalità.
La sopravvivenza a lungo termine è raggiunta solo nei pazienti con
tumore che coinvolge meno di 5 centimetri dell’esofago e che non hanno
né ostruzione, né diffusione extraesofagea (T1NoMo). I pazienti con
carcinoma esofageo raramente rispondono a questi criteri. La maggior
parte dei pazienti muore per la malattia entro 10 mesi dalla diagnosi.
L’associazione della terapia radiante (da 5500 a 6000 cGy) con mono o
polichemio può conseguire un’apprezzabile, ma temporanea, riduzione
della massa tumorale, penalizzata da rilevante tossicità, ma gli studi
clinici randomizzati, finora condotti, non hanno evidenziato la
capacità di chemio e/o radioterapia di incrementare significativamente
la mediane di sopravvivenza.
Caso clinico: Carcinoma esofageo (classificazione:T4N2Mx)
Profilo anagrafico del paziente:
anno di nascita: 1924; luogo di nascita: Roma;
sesso: maschio; professione: pensionato (ex geometra).
Anamnesi: Il paziente M.D. (età 70 anni circa) inizia (da circa
3 mesi) ad accusare disfagia, accompagnata da senso di bruciore in
regione retro-sternale e presenza di dolore di media entità irradiato a
tutta la regione addominale della durata di alcuni minuti e più volte
durante la giornata. Rigurgiti alimentari e calo ponderale (6 kg./3
mesi). Riferisce inoltre cambiamento dell’alvo tendenzialmente stitico
nell’ultimo mese.
Anamnesi remota: Pleurite all’età di 10 anni, a 21 anni frattura
della base cranica, clavicola dx e perforazione timpano dx in seguito
ad incidente motociclistico. Broncopolmonite bilaterale all’età di 30
anni, all’età di 31 anni esoftalmo occhio sx per ipertiroidismo.
Dall’età di 50 anni circa affetto da ipertensione arteriosa 180/110
mm/Hg trattata farmacologicamente a domicilio.
Inizia accertamenti del caso:
2/3/1995 - ANGIO TC torace addome rivela… “ispessimento delle
pareti del terzo distale dell’esofago toracico e della giunzione
esofago-gastrica con presenza di manifestazione diverticolare.
Linfonodi di 1 cm. in sede pericardiale ed a livello della gastrica
sinistra. …”.
Il paziente viene ricoverato c/o III Clinica Chirurgica - Pol. “Umberto I” di Roma
3/3/1995 - Eseguito EGDS “... a 36 cm. dall’arcata dentaria
superiore è presente un diverticolo con ampio colletto (si esegue
biopsia) contenente residui alimentari …”.
28/3/1995 - Istologico: Carcinoma scarsamente differenziato superficialmente ulcerato
4/4/1995 – TAC
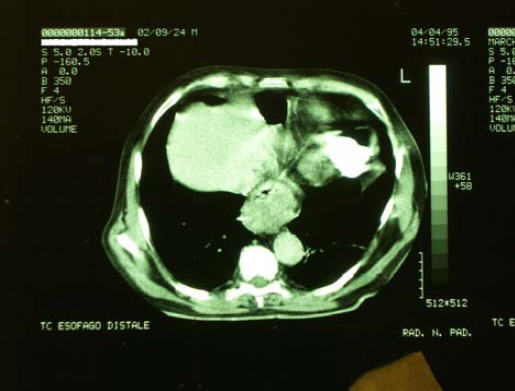
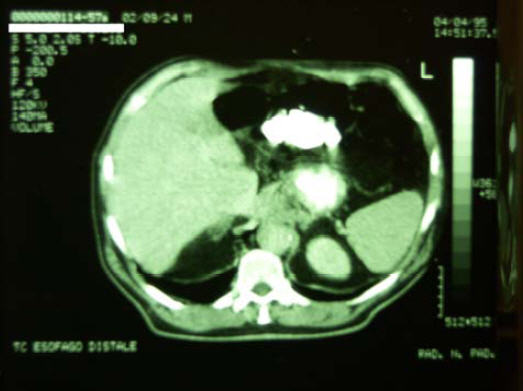
19/4/1995 - Viene sottoposto a “Laparotomia esplorativa”
con l’intento di posizionare un Port-acath utile a consentire una
infusione continua di trattamenti chemioterapici ed inoltre a valutare
l’eventuale possibilità di endoprotesi.
L’esito dell’intervento è palliativo e accerta l’impossibilità di exeresi chirurgica della neoplasia.
Referto della laparotomia esplorativa: “… voluminosa neoplasia esofagea… che invade il tessuto periesofageo ed il diaframma e si diffonde a caduta nel retroperitoneo, sullo stomaco e al pancreas che vi aderisce strettamente. Nel mediastino si palpano e si dimostrano grossolane gittate verosimilmente neoplastiche. Molti linfonodi regionali ed extraregionali sono aumentati di volume”.
Considerando la gravità della diffusione locale, toraco-addominale
della neoplasia, l’età e le condizioni generali del paziente, si rinuncia a proseguire l’intervento...”.
Viene sottoposto a trattamenti combinati chemioterapici, con riduzione
della massa valutabile intorno al 50% (8 cicli 5 FU + mitomicina - 28
cicli radioterapici ).
In data 28/10/1995
il trattamento viene sospeso a causa di sanguinamento e melena, e non
viene ritenuto possibile ripetere i trattamenti chemioterapici e viene
dimesso consigliando unicamente una terapia antidolorifica e di
supporto. Progressione tumorale.
Dicembre 1995: Progressione tumorale e inizio MDB
4/4/96 - Viene ricoverato per una Broncopolmonite Basale dx. all’Ospedale “Forlanini” di Roma.
Diagnosticata una Cardiopatia degenerativa con insufficienza mitralica lieve.
2/5/96 - Viene dimesso, dopo i trattamenti del caso.
3/4/97 - TAC di controllo evidenzia una: “complessiva riduzione dell’ispessimento al 3° distale esofageo:
“… l’esame TC del torace e dell’addome eseguito prima e dopo per
fusione e.v. di mdc iodato, con tecnica di acquisizione volumetrica, ha
mostrato una complessiva riduzione dell’irregolare ispessimento del
tessuto periesofageo al 3° distale, in sede sovra e sottocardiale, con
interessamento del fondo gastrico. L’area di interesse mostra subire un
evidente enhancement alla perfusione del mdc iodato…”.
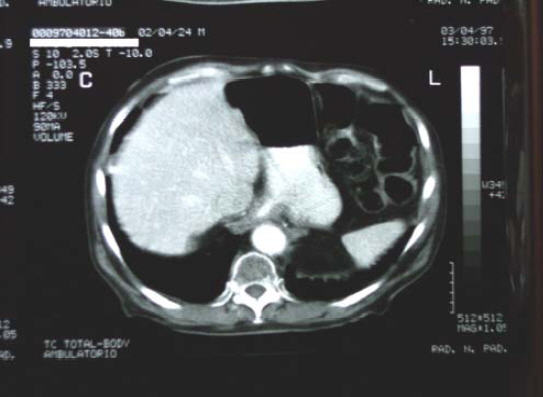
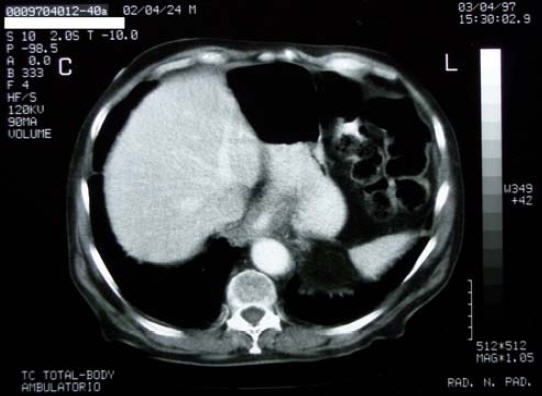
29/10/97 - Ricovero ospedaliero per DISFAGIA
Viene eseguita EGDS + biopsia, per valutare eventuale posizionamento di protesi.
Referto: Esplorazione endoscopica negativa dell’esofago prossimale. A
livello sovracardiale estendentesi fino sotto il cardias in sede
fundica si reperta processo infiltrativo con sensibile riduzione del
lume esofageo e lesioni necrotiche. Consistenza dura al prelievo
bioptico. L’istologico della biopsia della zona sovracardiale ispessita
e sospetta esclude la presenza di cellule neoplastiche.
Istologico: Mucosa gastrica con intensa flogosi acuta e cronica e detriti da fondo di ulcerazioni.
20/7/1998 - Eseguita TC Total Body di controllo
TC torace:
Esame eseguito dopo somministrazione di mdc. Non evidenti alterazioni
tomodensitometriche di tipo focale a carico dei parenchimi polmonari.
Evidenza di aree disventilatorie in sede basale sn; non evidenza di
linfoadenopatie di rilevanza clinica a carico delle principali stazioni
linfonodali mediastiniche.
Non versamento pleurico.
TC addome:
Le scansioni eseguite con acquisizione volumetrica a partire dal terzo
distale dell’esofago evidenziano un ispessimento parietale del tratto
esofageo esaminato, con marcato enhancement delle pareti, non evidenza
del lume, contatto con la parete dell’aorta ascendente; non evidenti
significative linfoadenopatie loco - regionali.
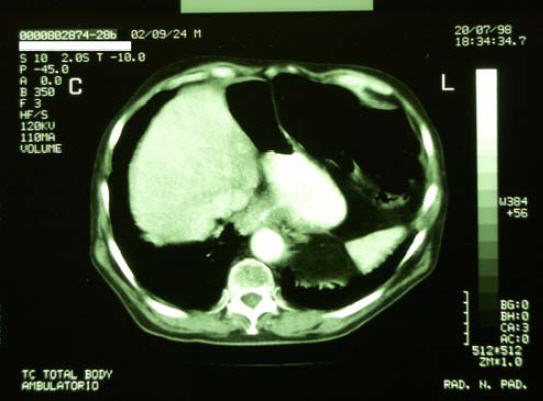
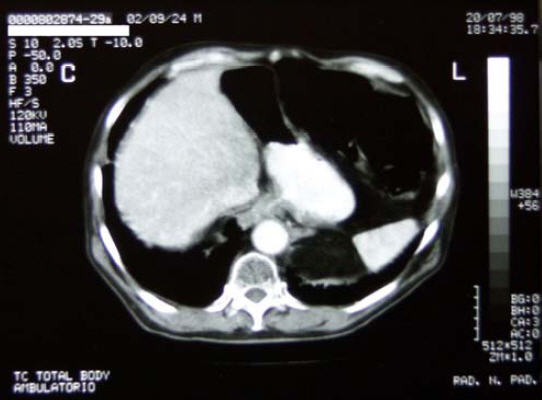
28/1/1999 - TC Total Body di controllo
Referto: TC torace - addome e pelvi:
Non si apprezzano lesioni tomodensitometriche a focolaio. Il sistema
ventricolare è in asse non dilatato. Addensamento parenchimale a
margini lievemente sfumati in sede basale paracardiaca posteriore dx.
Ispessimento e disomogeneità dell’esofago toracico e
trans-diaframmatico con aspetto fortemente sfumato ed irregolare e
conseguente riduzione del lume del viscere. Aumento di densità del
grasso periviscerale nel tratto sottodiaframmatico. Si apprezzano
alcune adenopatie di Ø ai limiti della norma in sede pre e
retrocarenale azygotica. Lo studio del fegato non permette di
evidenziare lesioni tomodensitometriche a focolaio in atto.
Nulla da segnalare a carico della colecisti. Non significative
alterazioni a carico del pancreas, in involuzione adiposa. Non
alterazioni a carico della milza.
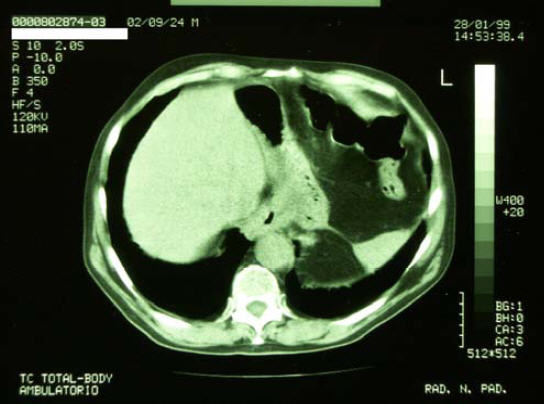
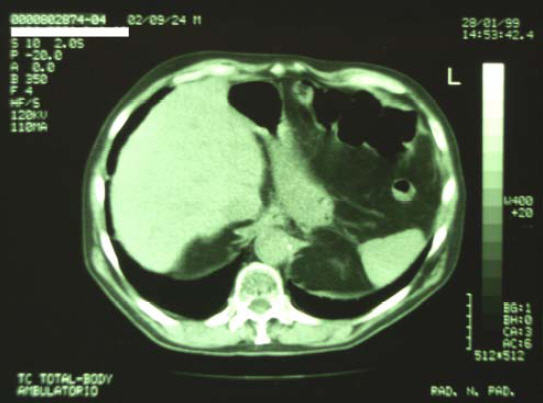
1/10/2000 - Ricovero ospedaliero per episodi di MELENA
Diagnosi: emorragia acuta e anemia acuta post-emorragica
Eseguita EGDS - referto:
agevole introduzione dello strumento endoscopico. Negativa esplorazione dell’esofago prossimale. A livello del 3° distale si osserva restringimento ed ipoelasticità della parete esofagea per tutta la circonferenza senza evidente infiltrazione:
si riesce con difficoltà a procedere ed in sede cardiale, sulla parete
anteriore, si reperta ampia lesione necrotica di circa 2 cm. già più
volte in precedenza descritta che marginalmente, solo in un punto,
presenta area di mucosa iperemia con probabili segni di recente
sanguinamento. Si esplora il cavo gastrico esente da lesioni. Iperemia
della mucosa duodenale con discreta fragilità da contatto. In tutto il
tratto esplorato non si osservano segni di sanguinamento in atto.
Valori ematochimici patologici:
GR 2260000-2900000; Hb 6.6 gr% - 9 gr%; Hti20-28%; VES 50; Glicemia 146; Albuminemia: 2.95 gr/dI.
Viene sottoposto ad emotrasfusioni (6 unità), sospensione
dell’alimentazione orale, terapia con ranitidina e.v.(prima) e con
omeprazolo per os (dopo alcuni giorni)
9/10/2000 - Il paziente viene dimesso.
15/11/2001 - Ricovero ospedaliero in seguito ad episodio epilettico notturno.
Eseguita Tc Cerebrale che “... Dimostra la presenza di una
piccola area di ipodensità localizzata a livello della sostanza bianca
adiacente il crocicchio ventricolare di sinistra da riferire ad esiti di
lesione su base cerebrovascolare ischemica. Apprezzabile una modesta
ipodensità diffusa a livello della sostanza periventricolare come per
condizione di sofferenza tissutale su base cerebrovascolare ischemica
cronica. Non evidenza di lesioni emorragiche”.
21/11/2001 - il paziente viene dimesso.
28/10/2004 - Eseguita TC Total Body di controllo:
torace: non evidenti nodulazioni e\o aree di consolidamento polmonari
di natura sospetta. Ispessimento pleurico scissurale sx in sede basale
con risalita dell'emidiaframma sx. Assenza di versamento pleurico.
Fissità con ispessimento concentrico parietale del terzo distale
dell’esofago toracico e della giunzione esofago-gastrica,
sostanzialmente immodificato rispetto ai precedenti controlli in
visione. Non evidenti tumefazioni linfonodali ilo-mediastinichee
sottodiaframmatiche. Fegato di normali dimensioni e morfologia, esente
da lesioni focali. Vie biliari non dilatate. Colecisti normodistesa con
pareti di normale spessore. Non evidenti alterazioni della milza, del
pancreas, dei surreni e del rene dx.
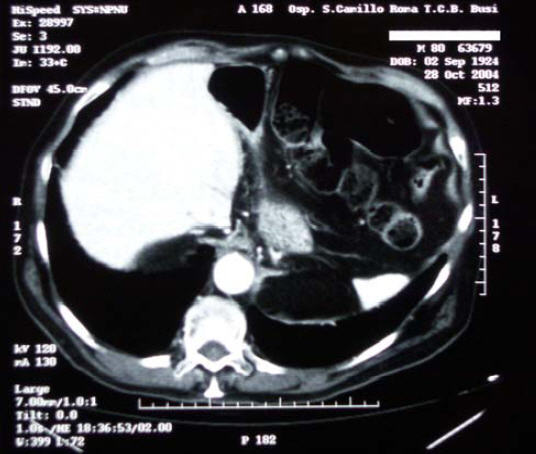
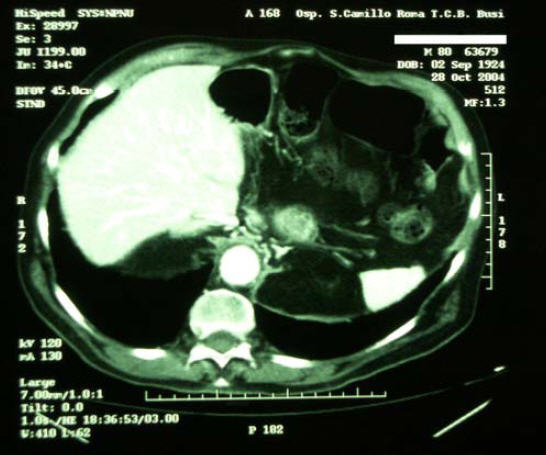
17/1/2007 - Eseguita TC Total Body di controllo
Referto:
torace: non evidenti alterazioni focali del parenchima polmonare. Non linfoadenopatie ilomediastiniche nè versamento pleurico.
Addome e pelvi: fegato con dimensioni nei limiti, densità parenchimale
esente da alterazioni focali. Vie biliari non dilatate, colecisti
distesa, alitiasica. Vena porta di calibro regolare e pervia. Surreni
con dimensioni e morfologia regolari. Milza nei limiti della norma.
Pancreas mal definibile. Reni in sede, rapporto cortico midollare
ridotto; cisti renale a sinistra, non ectasia calico pielica. Non
evidenti linfoadenopatie interaorto-cavali e lomboaortiche. Vescica
simmetricamente distesa con pareti omogenemente ispessite (vescica da
sforzo?). Ipertrofia prostatica con disomogenea densità e piccole
calcificazioni parenchimali Non linfoadenopatie iliaco-otturatorie. Il
paziente è tuttora vivente e in buone condizioni, si alimenta senza
difficoltà.
Attualmente ha ridotto la terapia iniziale ed segue i seguenti trattamenti farmacologici:
Sandostatina Lar 20mg - 1 iniezione intramuscolare ogni 28 gg.
Soluzione di retinoidi - 1 cucchiaio alla mattina a digiuno con Atiten (vit.D) - 9 gocce assieme ai retinoidi
Melatonina coniugata 2mg - 3 compresse dopo i pasti, ( 9 al dì)
Parlodel 2,5 mg - ¼ di compressa dopo i pasti x 3 volte al dì
oltre a:
Luminale - ½ compressa (crisi epilettica)
Enapren 20 - 1 compressa (ipertensione)
Lansox 30 mg - 1 compressa
Plasil 10 - 1 compressa
Venitrin T5 - 1 cerotto
Eutirox 100 - 1 compressa
Conclusioni
La terapia e il decorso clinico.
La chemioradioterapia aveva ottenuto una risposta obiettiva, ma solo parziale, della voluminosa neoplasia esofagea e della estensione periesofagea, oltre che al diaframma, retroperitoneo, stomaco e pancreas, linfonodi regionali ed extraregionali.
Alla ripresa della progressione locale, non potendo proseguire per la
grave tossicità con il trattamento chemioradioterapico e
nell’impossibilità di un’exeresi chirurgica, il paziente ha chiesto di
essere curato con il Metodo Di Bella, che prevede l’impiego sinergico
di molecole ad azione differenziante, citostatica, apoptotica,
antiproliferativa,antiangiogenica, antimetastatica con il potenziamento
dell’immunità. La somministrazione continuativa di dosaggi minimi, non
citolitici, e pertanto non mutageni, di ciclofosfamide, e grazie
all’azione mieloprotettiva, antidegenerativa e trofica su parenchimi e
tessuti, della MLT e degli alti dosaggi di Vitamina E, Retinoidi,
vitamine C e D3, ha evitato la tossicità midollare, epatorenale,
metabolica, cardiocircolatoria, neurologica e la depressione
immunitaria, consentendo un graduale recupero e mantenimento di un buon
performance status. I 100 milligrammi giornalieri x os continuativi per
oltre 1 anno di ciclofosfamide non hanno pertanto provocato sensibili
alterazioni della crasi ematica e della dinamica midollare. Il paziente
ha condotto a domicilio la terapia con una qualità di vita che gli ha
consentito di riprendere gradualmente l’attività lavorativa malgrado
l’età avanzata.
Farmaci somministrati [componenti della terapia prescritta (MDB)]:
1) Somatostatina (14 aminoacidi) 3 mg iniettati sottocute di notte
nell’arco di 10 ore mediante un temporizzatore per la breve emivita
(circa 3 minuti) in coincidenza del picco notturno di increzione del GH;
2) Octreotide, analogo della somatostatina (otto aminoacidi) in
formulazione ritardata 20 mg intramuscolo ogni 25 giorni, per una
completa saturazione, sia recettoriale che temporale, con potenziamento
antiproliferativo e proapoptotico antiangiogenico della somatostatina a
14 aminoacidi;
3) Bromocriptina da 2,5 mg, 1\2 compressa mattino e sera per
l’inibizione della prolattina, potente e ubiquituario ormone mitogeno;
4) 7g. di soluzione vitaminica (100 mg x Kg di peso corporeo), almeno
15’ prima del pasto, 3 volte al dì , secondo la formulazione del
professor Di Bella:
Beta carotene…………………… gr 2
Axeroftolo palmitato … …….. gr 1
Ac trans retinoico ( ATRA)…… gr 1
Alfatocoferile acetato ……….. gr 1000
5) Diidrotachisterolo (Vit D3 di sintesi) - 10 gocce nello stesso
cucchiaio assieme al soluzione vitaminica per ogni somministrazione (
30 gocce al dì);
6) Melatonina chimicamente complessata con adenosina (mediante un
legame di idrogeno) e glicina, secondo la formulazione del professor Di
Bella: Melatonina 12% Adenosina 51% Glicina 37%; compresse da 2
milligrammi , 2 mattino e mezzodì , otto dopo cena
7) Ciclofosfamide compresse 50 mg, una compressa 2 volte al dì;
8) Calcio 1 grammo 2 volte al dì in un bicchiere d’acqua;
9) Ac ascorbico 2 grammi, insieme al calcio nello stesso bicchiere d’acqua x 2 volte al dì durante il pasto;
10) Glucosamina solfato 500 mg x 3 volte al dì
11) Galattosamina solfato 500 mg x 3 volte al dì
Discussione
La terapia biologica neuro-immuno-endocrina del professor Luigi Di
Bella (MDB) ha lentamente e progressivamente ottenuto una risposta
obiettiva completa, in assenza di tossicità, attraverso un meccanismo
d’azione recettoriale, differenziante, apoptotico e antiproliferativo,
antiangiogenico con criteri, finalità e meccanismi d’azione totalmente
difformi dalle consuete terapie citotossiche e citolitiche, dimostrando
di potersi sostituire all’intervento chirurgico, alla radioterapia, e
alla chemioterapia che notoriamente non ha alcun potere di eradicare i
tumori solidi. In questo caso, per l’estesa diffusione neoplastica
extraesofagea con voluminose adenopatie disseminate in ambito
mediastinico ed addominale, e l’estensione periesofagea, oltre che al
diaframma, retroperitoneo, stomaco e pancreas, era stata esclusa una
soluzione chirurgica. La risposta obiettiva al MDB (Metodo Di Bella) si
è estesa alla risoluzione completa della lesione esofagea e delle sue
diramazioni.
Razionale della terapia
La perdita di differenziazione e la proliferazione, anche se in misura
diversa, sono denominatori comuni di tutte le neoplasie. L’espressione
recettoriale ubiquitaria della Prolattina [7, 21], e del GH [10, 35],
rappresenta una delle conferme del ruolo mitogeno diretto e
generalizzato di queste molecole. La proliferazione cellulare è
strettamente dipendente dalla Prolattina, dal GH, massimo fattore di
crescita, e da molecole mitogene GH dipendenti, da esso positivamente
regolate, come EGF, FGF, HGF, IGF1-2, NGF, PDGF, VEGF, TGF, oltre che
da fattori di crescita prodotti dall’apparato gastrointestinale, come
VIP, CCK, PG. Sia la proliferazione cellulare fisiologica che
neoplastica, avvengono per mezzo di queste stesse molecole, che la
cellula neoplastica utilizza in misura esponenziale rispetto a quella
sana. Antidoti biologici del GH, come Somatostatina e analoghi, non
riducono solo l’espressione e la trascrizione di fattori di crescita
altamente mitogeni, come IGF1-2 [9,28,61], EGF [64], FGF [47], ma
estendono la loro regolazione negativa ai rispettivi recettori con
evidenti riflessi antiproliferativi, e antiangiogenici [1, 4, 17, 25].
E’ noto come l’asse GH-IGF1 abbia una determinante influenza sullo
sviluppo biologico neoplastico. Gli IGFR rispondono mitogenicamente a
IGF. L’effetto soppressivo della SST e analoghi sui livelli sierici di
IGF1, è sia diretto, attraverso l’inibizione del gene di IGF, che
indiretto, mediante la soppressione del GH e pertanto della sua
induzione epatica di IGF1. Momenti essenziali dell’angiogenesi,
passaggio essenziale della progressione neoplastica, come la cascata
dei monociti [73], l’interleukina 8, fattori di crescita essenziali e
sinergici per lo sviluppo dell’angiogenesi, come il VEGF, TGF, IGF1,
FGF, HGF, PDGF, sono negativamente regolati da Somatostatina e analoghi
[1, 4, 9, 14, 25, 68, 69, 72]. L’inibizione dell’angiogenesi indotta
dalla SST è sinergicamente potenziata da MLT [11, 12, 36], Retinoidi
[31,42,45], vitamina D3 [32,44], Vitamina E [52,63,65] Vitamina C
[8,19,51], inibitori prolattinici [68], componenti della matrice
extracellulare [37,57]. Ugualmente l’effetto citostatico,
antiproliferativo, antimetastatico della Somatostatina è efficacemente
sinergizzato dagli altri componenti del MDB:
Retinoidi [56,58]
MLT [33,41]
Vit D3 [5,24]
Cabergolina e Bromocriptina ( inibitori prolattinici) [17,7]
Glucosamina solfato, condroitinsolfato solfato, componenti della matrice extracellulare [6,59]
Vit E [22,43,52,63,67]
Vit C [8,19,51]
E’ stato dimostrato il rapporto causale tra espressione recettoriale
del GH e induzione e progressione tumorale, rilevando istochimicamente
concentrazioni di GHR nettamente superiori nei tessuti tumorali,
rispetto ai fisiologici, evidenziando il potente ruolo mitogeno del GH
con indice proliferativo dose dipendente[35]. Esso è sia diretto,
recettoriale, che indiretto, attraverso l’induzione dell’espressione
epatica di IGF1, GH dipendente. L’asse GH-IGF1 ha un ruolo determinante
sul comportamento biologico di molte neoplasie. In un’elevatissima e
subtotale percentuale di varietà di cellule neoplastiche sono stati
individuati recettori IGF1, che rispondono mitogenicamente al ligando.
La Somatostatina esercita l’attività antiblastica sia direttamente,
attraverso l’inibizione dell’espressione del gene IGF1, che
indirettamente, mediante la soppressione del GH, da cui dipende
l’increzione di IGF1 [61]. Ampiamente documentata è anche l’attività
inibitoria della SST su un altro potente fattore di crescita mitogeno,
EGF, attraverso molteplici meccanismi:
- inibizione dose dipendente della fosforilazione tirosinica indotta dall’attivazione di EGFR da parte di EGF [49];
- riduzione di EGFR nelle cellule tumorali [64];
- riduzione dell’espressione di EGF [22];
- abbattimento della concentrazione plasmatica di EGF [9].
Mitogeni prodotti dall’apparato gastrointestinale, come VIP, CCK, PG,
sono potentemente inibiti dalla somatostatina e/o octreotide [28], la
cui efficacia è potenziata attraverso un meccanismo sinergico
fattoriale con gli altri componenti del MDB. La letteratura ha pertanto
confermato i meccanismi d’azione antineoplastici differenzianti e
antiproliferativi, antiangiogenetici e antimetastatici di tutti i
componenti del MDB. In questo caso gli esami ematochimici non hanno
evidenziato danni, o tossicità, indotti dal MDB. Il risultato
obiettivo, in assenza di tossicità, mediante la riduzione lenta e
progressiva fino alla scomparsa delle estese lesioni neoplastiche
iniziali, delle adenopatie, insieme al blocco di ogni progressione loco
regionale o disseminazione metastatica, evidenzia l’efficacia di questa
multiterapia ed è conforme ai positivi risultati già pubblicati
sull’uso di questo metodo nei LNH a basso grado e carcinomi polmonari
al 3° e 4° stadio. Il MDB, senza necessità di ricovero ospedaliero e
neppure di day hospital, in assenza di tossicità ha recuperato la
funzionalità esofagea, il trofismo e funzionalità di organi e tessuti,
consentendo, a distanza di tredici anni, una qualità di vita
fisiologica e attiva, fino all’età di 84 anni. Si può ragionevolmente
ipotizzare pertanto che l’applicazione precoce, e come terapia di prima
linea di questo metodo, in un organismo non debilitato dagli effetti
tossici, mutageni e immunodepressivi della chemio-radioterapia,
potrebbe conseguire risultati decisamente più rapidi. Riteniamo utile
segnalare il caso per invitare ad un maggiore interesse, studio e
approfondimento sulle possibilità aperte in oncologia dalla terapia
immunoneuroendocrina, biologica e recettoriale MDB.
Dottor Giuseppe Di Bella
Fondazione Di Bella - Bologna
e-mail:
posta@giuseppedibella.it
Indirizzo e-mail protetto dal bots spam , deve abilitare Javascript per vederlo
Telefono 051 239662; 051 230369 ; fax 051 2961238
Via Marconi 51, 40122 Bologna
References
1) Albini A, Florio T, Giunciuglio D, et al. Somatostatin controls
Kaposi’s sarcoma tumor growth through inhibition of angiogenesis. FASEB
J. 1999; 13(6): 647-655.
2) Ashino H, Shimamura M, Nakajima H, et al. Novel function of ascorbic acid as an angiostatic factor. Angiogenesis. 2003; 6(4): 259-269.
3) Barnett P. Somatostatin and somatostatin receptor physiology. Endocrine. 2003; 20(3): 255-264.
4) Barrie R, Woltering EA, Hajarizadeh H,. Inhibition of angiogenesis
by somatostatin and somatostatin-like compounds is structurally
dependent. J Surg Res. 1993; 55(4): 446-450.
5) Barroga EF, Kadosawa T, Okumura M,. Inhibitory effects of
22-oxa-calcitriol and all-trans retinoic acid on the growth of a canine
osteosarcoma derived cell-line in vivo and its pulmonary metastasis in
vivo. Res Vet Sci. 2000; 68(1): 79-87.
6) Batra RK, Olsen JC, Hoganson DK, Retroviral gene transfer is
inhibited by chondroitin sulfate proteoglycans/glycosaminoglycans in
malignant pleural effusions. J Biol Chem. 1997; 272(18): 11736-43.
7) Ben-Jonathan N, Liby K, McFarland M, Prolactin as an
autocrine/paracrine growth factor in human cancer. Trends Endocrinol
Metab. 2002; 13(6): 245-250.
8) Cameron E, Pauling L, Leibovitz B. Ascorbic acid and cancer: a review. Cancer Res. 1979; 39(3): 663-681.
9) Cascinu S, Del Ferro E, Ligi M, Staccioli, et al. Inhibition of
vascular endothelial growth factor by octreotide in colorectal cancer
patients. Cancer Invest. 2001; 19(1): 8-12.
10) De Souza I, Morgan L, Lewis UL, Growth-hormone dependence among human breast cancers. Lancet. 1974; 2(7874): 182-184.
11) Di Bella L, Gualano L. Key aspects of melatonin physiology: thirty years of research. Neuro Endocrinol Lett. 2006; 27(4): 425-432.
12) Di Bella L, Rossi MT, Scalera G. Perspectives in pineal functions. Prog Brain Res. 1979; 52: 475-478.
13) Dong LM, Kristal AR, Peters U, Dietary supplement use and risk of
neoplastic progression in esophageal adenocarcinoma: a prospective
study.Nutr Cancer. 2008 Jan-Feb;60(1): 39-48
14) Florio T, Morini M, Villa V, et al. Somatostatin inhibits tumor
angiogenesis and growth via somatostatin receptor-3-mediated regulation
of endothelial nitric oxide synthase and mitogenactivated protein
kinase activities. Endocrinology. 2003; 144(4): 1574-1584.
15) Giovannucci E, Liu Y, Willett WC.Cancer incidence and mortality and
vitamin D in black and white male health professionals.Cancer Epidemiol
Biomarkers Prev. 2006 Dec;15(12): 2467-72. Epub 2006 Nov 28.
16) Griffin M, Sweeney EC.The relationship of endocrine cells,
dysplasia and carcinoembryonic antigen in Barrett’s mucosa to
adenocarcinoma of the oesophagus.Histopathology. 1987 Jan;11(1): 53-62.
17) Gruszka A, Pawlikowski M, Kunert-Radek J. Anti-tumoral action of
octreotide and bromocriptine on the experimental rat prolactinoma:
anti-proliferative and pro-apoptotic effects. Neuro Endocrinol Lett.
2001; 22(5): 343-348.
18) Hashimoto Y, Shimada Y, Itami A, Growth inhibition through
activation of peroxisome proliferator-activated receptor gamma in human
oesophageal squamous cell carcinoma.Eur J Cancer. 2003 Oct;39(15):
2239-46.
19) Head KA. Ascorbic acid in the prevention and treatment of cancer. Altern Med Rev. 1998; 3(3): 174-186.
20) Held-Feindt J, Krisch B, Mentlein R. Molecular analysis of the
somatostatin receptor subtype 2 in human glioma cells. Brain Res Mol
Brain Res. 1999; 64(1): 101-7.
21) Hooghe R, Merchav S, Gaidano G, A role for growth hormone and prolactin in leukaemia and lymphoma? Cell Mol Life Sci. 1998; 54(10): 1095-1101.
22) Israel K, Yu W, Sanders BG, Kline K. Vitamin E succinate induces
apoptosis in human prostate cancer cells: role for Fas in vitamin E
succinate-triggered apoptosis. Nutr Cancer. 2000; 36(1): 90-100.
23) Jatoi A, Thomas CR Jr Esophageal cancer and the esophagus:
challenges and potential strategies for selective cytoprotection of the
tumor-bearing organ during cancer treatment. Semin Radiat Oncol. 2002
Jan;12(1 Suppl 1): 62-7.
24) Jensen SS, Madsen MW, Lukas J, Binderup L, Bartek J. Inhibitory
effects of 1alpha, 25- dihydroxyvitamin D(3) on the G(1)-S
phase-controlling machinery. Mol Endocrinol. 2001; 15(8): 1370-1380.
25) Jia WD , Xu GL , Xu RN, et al. Octreotide acts as an antitumor
angiogenesis compound and suppresses tumor growth in nude mice bearing
human hepatocellular carcinoma xenografts. J Cancer Res Clin Oncol.
2003; 129(6): 327-334.
26) Jin Z, Mori Y, Hamilton JP, Hypermethylation of the somatostatin
promoter is a common, early event in human esophageal carcinogenesis.
Cancer. 2008 Jan 1;112(1): 43-9.
27) Kapil U, Srivastav M, Nayar D. Vitamin ‘A’ and oesophageal cancer. Trop Gastroenterol. 1993 Jul-Sep; 14(3):87-90.
28) Kath R, Höffken K. The significance of somatostatin analogues in
the antiproliferative treatment of carcinomas. Recent Results Cancer
Res. 2000; 153: 23-43.
29) Khuri FR, Kim ES, Lee JJ . The impact of smoking status, disease
stage, and index tumor site on second primary tumor incidence and tumor
recurrence in the head and neck retinoid chemoprevention trial. Cancer
Epidemiol Biomarkers Prev. 2001 Aug;10(8): 823-9.
30) Kidd PM. The use of mushroom glucans and proteoglycans in cancer treatment.Altern Med Rev. 2000 Feb;5(1): 4-27. Review.
31) Kini AR, Peterson LA, Tallman MS, Lingen MW. Angiogenesis in acute
promyelocytic leukemia: induction by vascular endothelial growth factor
and inhibition by all-trans retinoic acid. Blood. 2001; 97(12): 3919-3924
32) Kisker O, Onizuka S, Becker CM, Fannon M, Flynn E, D’Amato R, et
al. Vitamin D binding protein-macrophage activating factor (DBP-maf)
inhibits angiogenesis and tumor growth in mice. Neoplasia. 2003; 5(1):
32-40.
33) Kvetnoĭ IM, Levin IM. Melatonin and tumor growth. (In Russian with English abstract). Eksp Onkol. 1986; 8(4): 11-15.
34) Launoy G, Milan C, Day NE, Pienkowski MP,.Diet and squamous-cell
cancer of the oesophagus: a French multicentre case-control study.Int J
Cancer. 1998 Mar 30;76(1): 7-12.
35) Lincoln DT, Sinowatz F, Temmim-Baker L, et al. Growth hormone
receptor expression in the nucleus and cytoplasm of normal and
neoplastic cells. Histochem Cell Biol. 1998; 109(2): 141-159
36) Lissoni P, Rovelli F, Malugani F, Bucovec R, Conti A, Maestroni GJ.
Anti-angiogenic activity of melatonin in advanced cancer patients.
Neuro Endocrinol Lett. 2001; 22(1): 45-47.
37) Liu G, Wu M, Levi G, Inhibition of cancer cell growth by all-trans
retinoic acid and its analog N-(4-hydroxyphenyl) retinamide: a possible
mechanism of action via regulation of retinoid receptors expression.
Int J Cancer. 1998 Oct 5;78(2): 248-54.
38) Liu Y, Yang H, Otaka K, Takatsuki H, Sakanishi A. Effects of
vascular endothelial growth factor (VEGF) and chondroitin sulfate A on
human monocytic THP-1 cell migration. Colloids Surf B Biointerfaces.
2005; 43(3-4): 216-220.
39) Lotan R. Retinoids and chemoprevention of aerodigestive tract cancers Cancer Metastasis Rev. 1997 Sep-Dec;16(3-4): 349-56.
40) Lubin JH, Virtamo J, Weinstein SJ.Cigarette smoking and cancer:
intensity patterns in the alpha-tocopherol, beta-carotene cancer
prevention study in Finnish men. Am J Epidemiol. 2008 Apr 15;167(8):
970-5. Epub 2008 Feb 3.
41) Maestroni GJ, Hertens E, Galli P, Conti A, Pedrinis E.
Melatonin-induced T-helper cell hematopoietic cytokines resembling both
interleukin-4 and dynorphin. J Pineal Res. 1996; 21(3): 131-9.
42) Majewski S, Szmurlo A, Marczak M, Jablonska S, Bollag W.
Synergistic effect of retinoids and interferon alpha on tumor-induced
angiogenesis: anti-angiogenic effect on HPV-harboring tumor-cell lines.
Int J Cancer. 1994; 57(1): 81-85.
43) Malafa MP, Fokum FD, Smith L, Louis A. Inhibition of angiogenesis
and promotion of melanoma dormancy by vitamin E succinate. Ann Surg
Oncol. 2002; 9(10): 1023-1032.
44) Mantell DJ, Owens PE, Bundred NJ, Mawer EB, Canfield AE. 1
alpha,25-dihydroxyvitamin D(3) inhibits angiogenesis in vitro and in
vivo. Circ Res. 2000; 87(3): 214-220.
45) McMillan K, Perepelitsyn I, Wang Z, Shapshay SM. Tumor growth
inhibition and regression induced by photothermal vascular targeting
and angiogenesis inhibitor retinoic acid. Cancer Lett. 1999; 137(1): 35-44.
46) Meggouh F, Lointier P, Pezet D, Evidence of 1,25-dihydroxyvitamin
D3-receptors in human digestive mucosa and carcinoma tissue biopsies
taken at different levels of the digestive tract, in 152 patients.J
Steroid Biochem 1990 Jun;36 (1-2): 143-7.
47) Mentlein R, Eichler O, Forstreuter F, Held-Feindt J. Somatostatin
inhibits the production of vascular endothelial growth factor in human
glioma cells. Int J Cancer. 2001; 92(4): 545-550.
48) Mikami S, Ohashi K, Usui Y, Nemoto T, Katsube K, Yanagishita M,
Nakajima M, Nakamura K, Koike M. Loss of syndecan-1 and increased
expression of heparanase in invasive esophageal carcinomas Jpn J Cancer
Res. 2001 Oct;92(10): 1062-73.
49) Mishima M, Yano T, Jimbo H, Yano N, Morita Y, Yoshikawa H, et al.
Inhibition of human endometrial cancer cell growth in vitro and in vivo
by somatostatin analog RC-160. Am J Obstet Gynecol. 1999; 181(3): 583-590.
50) Muller A, Nakagawa H, Rustgi AK. Retinoic acid and
N-(4-hydroxy-phenyl) retinamide suppress growth of esophageal squamous
carcinoma cell lines. Cancer Lett. 1997 Feb 26;113(1-2): 95-101.
51) Murata A, Morishige F, Yamaguchi H. Prolongation of survival times
of terminal cancer patients by administration of large doses of
ascorbate. Int J Vitam Nutr Res Suppl. 1982; 23: 103-113.
52) Neuzil J, Kagedal K, Andera L, Weber C, Brunk UT. Vitamin E
analogs: a new class of multiple action agents with anti-neoplastic and
anti-atherogenic activity. Apoptosis. 2002; 7(2): 179-87.
53) Norsa A. and Martino V., Somatostatin, Retinoidi, Melatonin,
Vitamin D, Bromocriptine, and Cyclophosphamide in
Chemotherapy-Pretreated Patients with Advanced Lung Adenocarcinoma and
Low Performance Status. Cancer Biotherapy & Radiopharmaceuticals
Volume 22, Number 1, 2007.
54) Odeleye OE, Eskelson CD, Mufti SI, Watson RR Vitamin E inhibition
of lipid peroxidation and ethanol-mediated promotion of esophageal
tumorigenesis. Nutr Cancer. 1992; 17(3):223-34.
55) Odeleye OE, Eskelson CD, Mufti SI, Watson RR.Vitamin E protection against nitrosamineinduced
esophageal tumor incidence in mice immunocompromised by retroviral infection. Carcinogenesis. 1992 Oct;13(10): 1811-6.
56) Onogi N, Okuno M, Matsushima-Nishiwaki R, Fukutomi Y, Moriwaki H,
Muto Y, et al. Antiproliferative effect of carotenoids on human colon
cancer cells without conversion to retinoic acid. Nutr Cancer. 1998; 32(1): 20-24.
57) Ozerdem U, Stallcup WB. Pathological angiogenesis is reduced by
targeting pericytes via the NG2 proteoglycan. Angiogenesis. 2004; 7(3): 269-276.
58) Piedrafita FJ, Pfahl M. Retinoid-induced apoptosis and Sp1 cleavage
occur independently of transcription and require caspase activation.
Mol Cell Biol. 1997; 17(11): 6348-58.
59) Pumphrey CY, Theus AM, Li S, Parrish RS, Sanderson RD. Neoglycans, carbodiimide-modified
glycosaminoglycans: a new class of anticancer agents that inhibit
cancer cell proliferation and induce apoptosis. Cancer Res. 2002; 62(13): 3722-8.
60) Roth AD, Morant R, Alberto P High dose etretinate and
interferon-alpha--a phase I study in squamous cell carcinomas and
transitional cell carcinomas. Acta Oncol. 1999;38(5): 613-7.
61) Schally AV, Comaru-Schally AM, Nagy A, Kovacs M, Szepeshazi K,
Plonowski A, et al. Hypothalamic hormones and cancer. Front
Neuroendocrinol. 2001; 22(4): 248-291.
62) Shimizu M, Suzui M, Deguchi A,. Effects of acyclic retinoid on
growth, cell cycle control, epidermal growth factor receptor signaling,
and gene expression in human squamous cell carcinoma cells. Clin Cancer
Res. 2004 Feb 1;10(3): 1130-40.
63) Shklar G, Schwartz JL. Vitamin E inhibits experimental
carcinogenesis and tumour angiogenesis. Eur J Cancer B Oral Oncol.
1996; 32B(2): 114-119.
64) Szepesházi K, Halmos G, Schally AV, Arencibia JM, Groot K,
Vadillo-Buenfil M, et al. Growth inhibition of experimental pancreatic
cancers and sustained reduction in epidermal growth factor receptors
during therapy.
65) Tang FY, Meydani M. Green tea catechins and vitamin E inhibit
angiogenesis of human microvascular endothelial cells through
suppression of IL-8 production. Nutr Cancer. 2001; 41(1-2): 119-125.
66) Todisco M., MD, Piergiorgio Casaccia, MD e Nazzareno Rossi, ASL 13
in Sondrio e ASL 106 in Teramo. Ciclofosfamide piu’ somatostatina,
bromocriptina, retinoidi, melatonina e ACTH nel trattamento dei linfomi
non –Hodgkin di basso grado in stadio avanzato: risultati di una
sperimentazione di fase 2. Cancer Biotherapy & Radiopharmaceuticals
Volume 16, Number 2, 2001 Mary Ann Liebert, Inc.
67) Turley JM, Funakoshi S, Ruscetti FW, Kasper J, Murphy WJ, Longo DL,
et al. Growth inhibition and apoptosis of RL human B lymphoma cells by
vitamin E succinate and retinoic acid: role for transforming growth
factor beta. Cell Growth Differ. 1995; 6(6): 655-663.
68) Turner HE, Nagy Z, Gatter KC, Esiri MM, Harris AL, Wass JA.
Angiogenesis in pituitary adenomas - relationship to endocrine
function, treatment and outcome. J Endocrinol. 2000; 165(2): 475-481.
69) Vidal S, Oliveira MC, Kovacs K, Scheithauer BW, Lloyd R.
Immunolocalization of vascular endothelial growth factor in the GH3
cell line. Cell Tissue Res. 2000; 300(1): 83-88.
70) Wang C, Tammi M, Guo H, Tammi R.Hyaluronan. Distribution in the
normal epithelium of esophagus, stomach, and colon and their cancers.Am
J Pathol. 1996 Jun;148(6): 1861-9.
71) Wang ZH, Yam HF, Or PC, Yang L . Effects of all-trans-retinoic acid
on human esophageal carcinoma cells and their nuclear matrices.
Anticancer Res. 1999 Jan-Feb;19(1A): 563-8.
72) Watson JC, Balster DA, Gebhardt BM, O'Dorisio TM, O’Dorisio MS,
Espenan GD, et al. Growing vascular endothelial cells express
somatostatin subtype 2 receptors. Br J Cancer. 2001; 85(2): 266-272.
73) Wiedermann CJ, Reinisch N, Braunsteiner H. Stimulation of monocyte
chemotaxis by human growth hormone and its deactivation by
somatostatin. BZou XN, Taylor PR, Mark SD, lood. 1993; 82(3): 954-960.
Home > Free Back to top
Nessun commento per questo articolo
Aggiungi commento
|
|
|
|
|
Libreria Ritorno al Reale
EFFEDIEFFESHOP.com
La libreria on-line di EFFEDIEFFE: una selezione di oltre 1300 testi, molti introvabili, in linea con lo spirito editoriale che ci contraddistingue.
|
|
|
|
|
|
Servizi online EFFEDIEFFE.com
|
|
Redazione : Conoscete tutti i collaboratori EFFEDIEFFE.com
|
Contatta EFFEDIEFFE : Come
raggiungerci e come contattarci
per telefono e email.
|
RSS : Rimani aggiornato con i nostri Web feeds
|
|
|
|
|
|
|
Il sito www.effedieffe.com.non è un "prodotto editoriale diffuso al pubblico con periodicità regolare e contraddistinto da una testata", come richiede la legge numero 62 del 7 marzo 2001. Gli aggiornamenti vengono effettuati senza alcuna scadenza fissa e/o periodicità
|
|
|